Вознесенская Юлия Владимировна, гинеколог-репродуктолог, руководитель школы репродуктологии EMC Medical School, руководитель Клиники репродуктивной и пренатальной медицины Европейского Медицинского Центра, Москва
Володяев Илья Владимирович, к.б.н., эмбриолог Клиники репродуктивной и пренатальной медицины Европейского Медицинского Центра, с.н.с. кафедры эмбриологии Биологического факультета МГУ
им. М.В. Ломоносова, Москва
Боярский Константин Юрьевич, к.м.н., доцент кафедры акушерства и гинекологии СПбГПМА, заведующий отделением репродукции и планирования семьи центра репродукции «Генезис»
Карева Елена Николаевна, д.м.н., проф. кафедры молекулярной фармакологии и радиобиологии им. академика РАМН П.В.Сергеева Медико-биологического факультета РНИМУ
им. Н.И. Пирогова, проф. кафедры фармакологии Лечебного факультета Первого МГМУ им. И.М. Сеченова, Москва
Зверева Ирина Олеговна, к.х.н., доцент кафедры аналитической химии им. Алимарина И.П. отделения фундаментальной и инженерной химии Института тонких химических технологий им. М.В. Ломоносова, эмбриолог ООО “КДФ-Москва”
Резюме
Фундаментальные механизмы, лежащие в основе женской фертильности с точки зрения формирования полноценного ооцита, оплодотворение которого приведет к нормальной беременности и рождению здорового ребенка, все еще остаются в значительной степени неизвестными. Тем не менее, в настоящее время определены «точки» в женском организме, влияя через которые появляются возможности для прицельной коррекции репродуктивного здоровья женщины, вплоть до программирования искусственного менструального цикла, получения большего количества яйцеклеток, чем это предусмотрено физиологией, и преодоления бесплодия различной этиологии. Этими «точками» являются стадии инициации примордиальных фолликулов, их преантрального роста, затем – роста антральных фолликулов и отбора доминантного из них. Известно, что все эти процессы находятся под чуткой регуляцией целого ряда гормонов, одним из которых является чФСГ.
Данный гормон в организме человека представлен большим разнообразием гликоформ, физиологические функции и потенциальные различия между которыми остаются в основном неизвестными. Интересной гипотезой является то, что гликоформы чФСГ функционируют на разных стадиях развития фолликула, что в таком случае объясняло бы изменение паттернов гликозилирования чФСГ в течение менструального цикла, однако подтверждений влияния той или иной конкретной гликоформы на определенной фазе менструального цикла к настоящему времени также нет. Тем не менее получены данные, подтверждающие влияние различных паттернов гликозилирования на связывание чФСГ с рецептором и последующем воздействии на определенные внутриклеточные сигнальные системы и функции клеток.
Таким образом, гликоформы чФСГ проявляют различную биологическую активность, а также могут обладать разными фармакокинетическими характеристиками, например в скорости связывания с рецептором и периодом полувыведения, что необходимо учитывать при разработке фармацевтического препарата чФСГ, расчете его дозировки и особенностей приема. Принимая изложенное выше во внимание, можно сделать вывод, что новая молекула рекомбинантного фолликулостимулирующего гормона человека – фоллитропин дельта – представляет собой первый рекомбинантный препарат чФСГ, продуцируемый с использованием клеточной линии человека, характеризующийся сопоставимыми характеристиками по эффективности при сравнении с разработанными ранее и используемыми уже на протяжении длительного времени фоллитропинами альфа и бета, также обладает рядом дополнительных преимуществ. Благодаря особому паттерну гликозилирования, максимально схожему с человеческим, а также четкому индивидуализированному алгоритму дозирования (основанному на уровне сывороточного антимюллерова гормона и массе тела пациентки), фоллитропин дельта демонстрирует более благоприятный профиль безопасности и снижает вероятность чрезмерного ответа яичников на овариальную стимуляцию, что особенно важно при лечении пациенток с низким ответом яичников и девушек с синдромом поликистозных яичников.
Список использованных сокращений
АМГ – антимюллеров гормон АТФ – аденозинтрифосфат АЦ – аденилатциклаза
ДАГ – диацилглицерин
ГнРГ – гонадотропин-рилизинг-гормон ДИ – доверительный интервал
EM – Европейское медицинское агентство
ИКСИ – интрацитоплазматическая инъекция сперматозоида (от англ. Intra Cytoplasmic Sperm Injection, ICSI)
ИМТ – индекс массы тела
КОС – контролируемая овариальная стимуляция
ЛГ – лютеинизирующий гормон (LH, от англ. Luteinizing Hormone) ОШ – отношение шансов
ПО – предел обнаружения
РКИ – рандомизированные контролируемые исследований
р-чЛГ– рекомбинантный человеческий лютеинизирующий гормон
р-чФСГ – рекомбинантный человеческий фолликулостимулирующий гормон р-чХГЧ – рекомбинантный человеческий хорионический гормон человека СГЯ – синдром гиперстимуляции яичников
СПКЯ – синдром поликистозных яичников ТТГ – тиреотропный гормон
ФСГ – фолликулостимулирующий гормон (FSH, от англ. Follicle-Stimulating Hormone) ФСГ-Р – рецептор ФСГ (FSHR от англ. Follicle Stimulating Hormone Receptor)
ХГЧ – хорионический гормон человека (hCG, от англ. Human Chorionic Gonadotropin) цАМФ – циклический аденозинмонофосфат
ЧМГ – человеческий менопаузальный гонадотропин
ЧМГ-ВО – мочевой высокоочищенный менопаузальный гонадотропин
ASGPR – асиалогликопротеиновый рецептор (от англ. Asialoglycoprotein receptor)
CHO – клеточная линия яичника китайского хомячка (от англ. Chinese hamster ovary) Cmax – максимальная концентрация вещества (лекарственного препарата)
CTP – карбокси-терминальный пептид (от англ. C-terminal peptide)
FDA – Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (от англ. US Food and Drug Administration)
GPCRs – рецептор, сопряженных с G-белком (англ. G-protein-coupled receptors, GPCRs)
i.v. – внутривенно
pI – изоэлектрическая точка (от англ. isoelectric point)
s.c. – подкожно
t1/2 – время полувыведения
Tmax – время достижения максимальной концентрации вещества в плазме
ВСТУПЛЕНИЕ
В современном мире проблема бесплодия в России и во всем мире является одной из самых актуальных. Согласно статистическим данным Всемирной организации здравоохранения (ВОЗ), около 48 млн пар и 186 млн людей страдают бесплодием, в России по оценкам специалистов каждая шестая пара сталкивается с бесплодием. Задача по преодолению бесплодия крайне актуальна, для ее решения научным врачебным сообществом постоянно идет поиск новых подходов лечения, а фармакологическими компаниями – новых лекарственных препаратов, культуральных сред для культивирования гамет и эмбрионов, а также разработка инструментов и микроинструментов, различных расходных материалов и так далее, которые позволят паре с бесплодием быстрее добиться беременности и рождения здорового ребенка. Одним из ключевых моментов преодоления бесплодия методами вспомогательных репродуктивных технологий является стимуляция суперовуляции гормональными препаратами, чаще всего фармацевтическими аналогами человеческого фолликулостимулирующего гормона (чФСГ). Идеальная стимуляция предполагает получение максимального количества яйцеклеток хорошего качества без побочных эффектов, некоторые из которых могут представлять серьезную угрозу для здоровья женщины. С учетом физиологических флуктуаций концентрации ФСГ в сыворотки крови женщины в зависимости от дня менструального цикла, состояния репродуктивной системы, а также большого разнообразия изоформ ФСГ, о чем будет рассказано подробнее в основной части работы, постоянно ведется поиск уникального препарата, который позволит учесть индивидуальные физиологические особенности каждой пациентки, а также смоделировать наиболее приближенный к физиологическому гормональный фон, и в то же время даст возможность разработать универсальный подход к его использованию. К сегодняшнему дню на фармацевтическом рынке представлен препарат чФСГ «Рековелль®», дозировка которого подбирается с учетом массы тела пациентки и сывороточной концентрации гормона, отображающего овариальный запас (АМГ – антимюллеров гормон). Индивидуальный расчет концентрации ФСГ позволяет значительно снизить риски развития синдрома гиперстимуляции яичников (СГЯ) – серьезного осложнения в результате стимуляции. Дополнительным преимуществом данного препарата является то, что для его получения используется клеточная линия человеческой ткани, что минимизирует возможность побочных эффектов со стороны иммунной системы.
Введение
Исторически поиск и разработка эффективных препаратов стимуляции овуляции начался с открытия, что гипофиз регулирует функцию гонад. Так, в исследованиях 1910 г. было показано, что удаление гипофиза у взрослых собак приводит к полной атрофии гонад, а у щенков – к отсутствию полового созревания [1]. Данные наблюдения легли в основу идеи об управлении гипофизом репродуктивной функции, которая была дополнительно подкреплена наблюдениями о гипопитуитаризме и как следствие атрофии гонад у мужчин и женщин с опухолями или повреждениями гипофиза, ножек гипофиза и мозговых центров, включая и расположенные выше продолговатого мозга [2, 3]. К 1930 г. результаты нескольких исследований свидетельствовали о преждевременном созревании репродуктивной функции у мышей, крыс, кошек, кроликов, морских свинок и коров при имплантации ткани передней доли гипофиза половозрелых самок к неполовозрелым животным, в то время как репродуктивная функция полностью утрачивалась после полной абляции гипофиза [3, 4]. Опираясь на полученные результаты, в 1929 г. B. Zondek предложил идею о секреции гипофизом двух гормонов, стимулирующих гонады, – пролан А и пролан Б, вероятно, от латинского слова «proles», что означает «потомок», имея в виду, что эти вещества были «spiritus movens» сексуальной функции, главными гормонами, которые контролируют все половые гормоны гонад и, следовательно, отвечают за продолжение вида. Чуть позже ученые B. Zondek и S. Asheim доказали присутствие в утренней моче беременных женщин соединений, при подкожной инъекции которых у незрелой подопытной мыши половые органы созревали за 4 дня (реакция Ашгейма–Цондека), что легло в основу первого лабораторного теста на беременность. В 1930 г. B. Zondek показал, что моча женщин в период постменопаузы также содержит соединения с аналогичным эффектом. Он предположил, что пролан А стимулирует рост фолликулов, а пролан А вместе с проланом В стимулирует секрецию «фолликулина», в то время как пролан В индуцирует овуляцию, образование желтого тела и секрецию лютеина и фолликулина. Эти два гормона вызывали железистую трансформацию и пролиферацию эндометрия, а также способствовали изменениям в эпителии влагалища. B. Zondek заключил, что динамика секреции пролана A передней долей гипофиза и правильное время выделения пролана B ответственны за ритмичность функционирования яичников, что, в свою очередь, и контролирует пролиферацию и функцию эндометрия, создавая оптимальные условия для созревания ооцита, оплодотворения и наступления беременности. Сегодня соединения пролан А, пролан Б, фолликулин и лютеин имеют названия лютеинизирующий гормон (ЛГ), фолликулостимулирующий гормон (ФСГ), эстроген и прогестерон соответственно, а гипотеза B. Zondek была подтверждена годом позже, когда из гипофиза выделили два различных гормона, один из которых действовал как фолликулостимулирующий фактор, а другой – как лютеинизирующий фактор [3].
Открытие хорионического гормона человека (ХГЧ) и ФСГ предопределило применение гормонов для лечения бесплодия у женщин. В данной части литературного обзора подробнее остановимся на изучении свойств ФСГ, механизме действия, функциях, а также на его применении в клинической практике.
Фолликулостимулирующий гормон
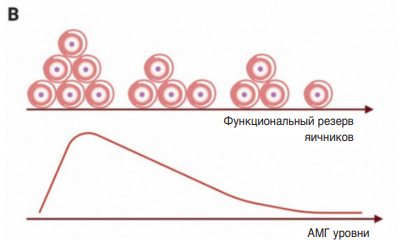
ФСГ принадлежит семейству гликопротеиновых гормонов, которое также включает гонадотропины ЛГ и ХГЧ, гипофизарный тиреотропный гормон (ТТГ) и недавно открытый гормон тиростимулин. ФСГ, ЛГ и ХГЧ представляют собой гетеродимеры и состоят из гликозилированных α- и β-субъединиц (рис. 1). α-Субъединица идентична для всех трех гормонов и состоит из 92 аминокислотных остатка, которые включают два сайта гликозилирования в положениях 52 и 78 по амидной группе боковых радикалов аминокислотных остатков аспарагин (Asp52 и Asp78). Данный тип связи считается N-гликозидной и образуется посредством присоединения N-ацетилглюкозамина. Трехмерная структура α-субъединицы представлена тремя петлями, которые стабилизированы пятью дисульфидными связями, образованными ковалентным взаимодействием между SH-группами боковых радикалов аминокислотных остатков цистеина в положениях 7-31, 59-87, 10-60, 28-82 и 32-84 соответственно. Три последних из них образуют структуру «цистеиновый узел».
Гормон-специфическая β-субъединица обладает 34–40% гомологией аминокислотных последовательностей среди представителей данного семейства и предопределяет различные биологические
Рис. 1. Схематическое изображение молекул гонадотропинов: ФСГ (А), ЛГ (В) и ХГЧ (С).
α-Субъединицы и β-субъединицы гетеродимеров обозначены красным и синим цветом соответственно; углеводные остатки – бледно-голубыми шариками. FSH – ФСГ (от англ. Follicle-Stimulating Hormone),
LH – ЛГ (от англ. Luteinizing hormone), hCG – ХГЧ (от англ. Human Chorionic Gonadotropin)
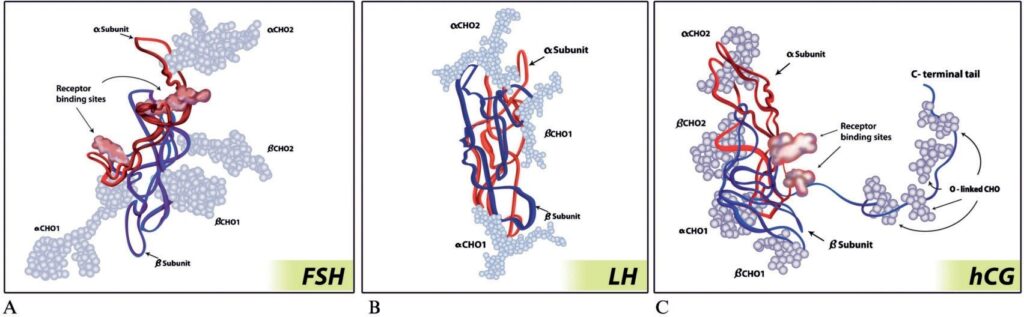
Рис. 2. Схематическое изображение молекулы ФСГ без обозначения углеводных компонентов: α-субъединица (FSHα, выделена зеленым) и β-субъединица (FSHβ, выделена синим). Желтым обозначены внутримолекулярные дисульфидные связи; αL1, αL2 и αL3 – петли третичной структуры α-субъединицы; βL1, βL2 и βL3 – петли третичной структуры β-субъединицы соответственно [6]
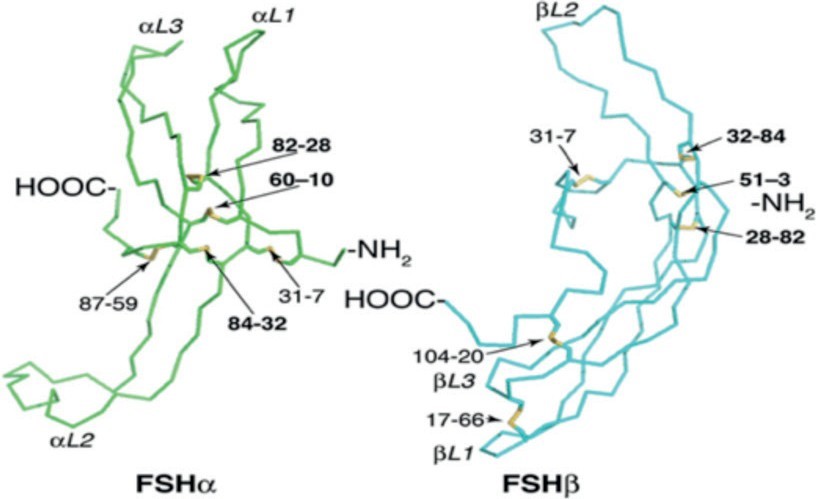
функции каждого из них. β-Субъединицы различаются не только первичной структурой в белковой части молекул, но и количеством углеводных остатков. В частности, β-субъединица ФСГ состоит из 111 аминокислотных остатков и включает два сайта гликозилирования в положениях 7 и 24 по амидной группе боковых радикалов аминокислотных остатков аспарагин (Asp7 и Asp24). Трехмерная структура β-субъединицы представлена тремя петлями, которые стабилизированы шестью дисульфидными связями, образованными ковалентным взаимодействием между SH-группами боковых радикалов аминокислотных остатков цистеина в положениях 7-31, 51-3, 20-104, 28-82, 17-66 и 32-84 соответственно. На рис. 2 схематично изображена трехмерная структура молекулы ФСГ [5].
Гликохимия ФСГ
Профиль гликозилирования ФСГ изменяется под воздействием различных физиологических состояний при наступлении периода полового созревания, зрелости, в течение менструального цикла, в зависимости от пола и возраста [7]. Изменения в гликозилировании ФСГ, циркулирующего в кровеносном русле, предопределяют его биологическую активность. Биоразнообразие изоформ ФСГ велико и демонстрирует как макрогетерогенность, так и микрогетерогенность углеводной части молекулы.
Макрогетерогенность
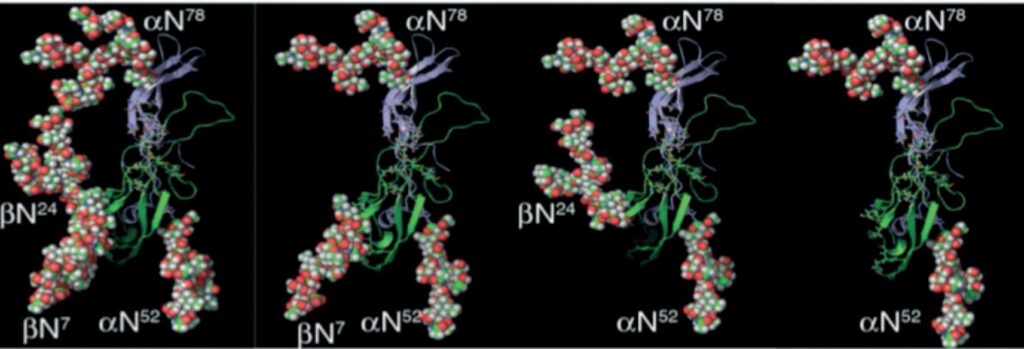
Как было уже отмечено, молекула ФСГ включает 4 углеводных остатка, которые составляют 20–30% от всей массы молекулы и играют ключевую роль в правильном фолдинге белка, олигомеризации, сортинге и транспорте [8]. Каждая субъединица гетеродимера ФСГ включает по два сайта гликозилирования в положениях Asn52 и Asn78 у α-субъединицы и Asn7, Asn24 – у β-субъединицы (рис. 3).
Макрогетерогенность ФСГ выражается в присутствии или отсутствии углеводной компоненты в каждом из потенциально возможных сайтов гликозилирования. Так, в природе встречается четыре изоформы: чФСГ-24, чФСГ-21, чФСГ-18 и чФСГ-15 с молекулярной массой β-субъединиц 24, 21, 18 и 15 кДа соответственно (рис. 4).
Изоформа чФСГ-24 с молекулярной массой β-субъединицы 24 кДа является полностью гликозилированной и характеризуется наличием углеводных компонентов по всем четырем сайтам гликозилирования. Изоформа чФСГ-21 с молекулярной массой β-субъединицы 21 кДа характеризуется отсутствием углеводного остатка в положении 24, в то время как у изоформы чФСГ-18 отсутствует углеводный остаток в положении 7 β-субъединицы. Изоформа чФСГ-15 представляет собой гетеродимер с полностью дегликозилированной β-субъединицей. Стоит отметить, что макрогетерогенность углеводной части ФСГ представлена изменениями углеводной части молекулы только в составе β-субъединицы.
Показано, что превалирующее количество низкомолекулярных гликоформ гормона, чФСГ-21, коррелирует с возрастом женщины: изоформа чФСГ-21 более распространена в гипофизарных экстрактах молодых женщин и уменьшается с увеличением возраста, ввиду чего соотношение чФСГ-21 к чФСГ-24 уменьшается. К примеру, в препаратах ФСГ, полученных из экстрактов гипофиза и мочи
Рис. 3. Схематическое изображение первичной и четвертичной структур α-субъединицы (вверху, А) и β-субъединицы ФСГ (внизу, В). Скобами обозначены дисульфидные связи, толстыми линиями – те, что образуют структуры «цистеиновый узел». Типичные последовательности в сайтах
N – гликозилирования Asn-X-Ser/Thr, где Х – любая аминокислота за исключением пролина, подчеркнуты. Углеводные компоненты обозначены зеленым и голубым соответственно [9]
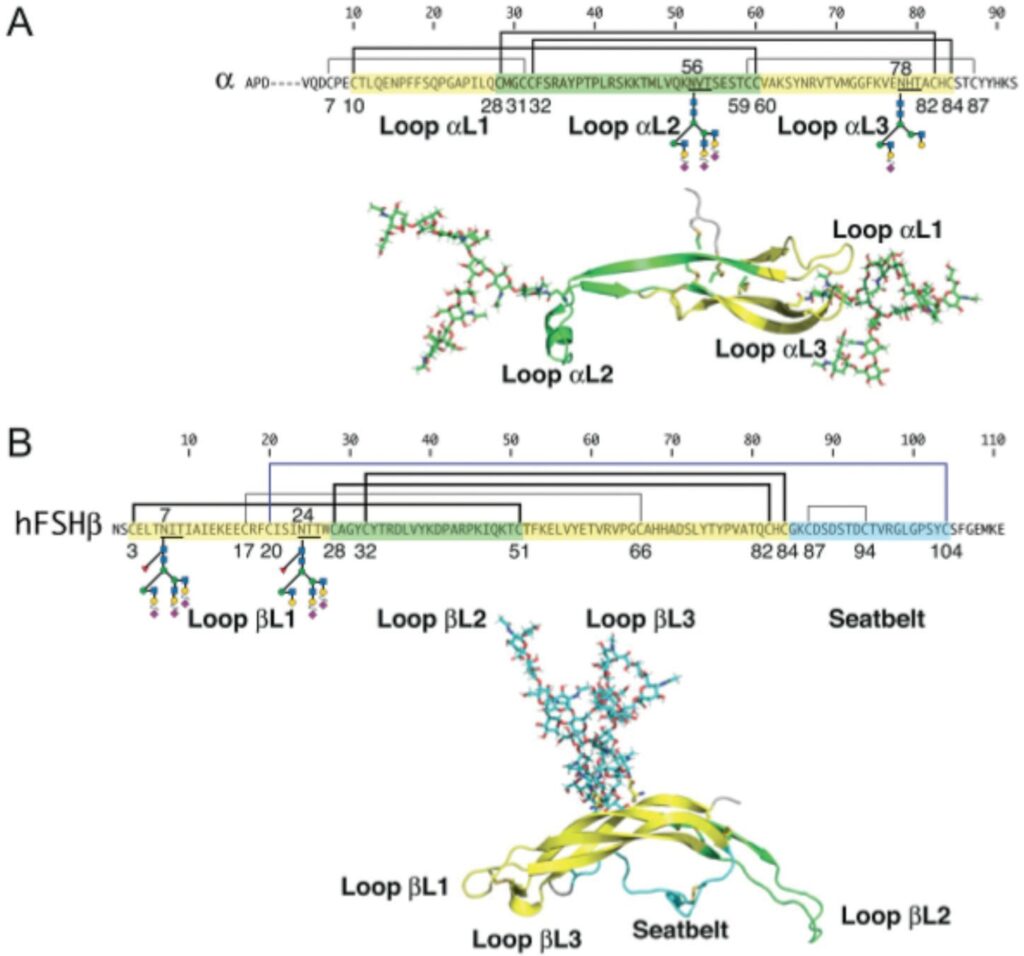
Рис. 4. Трехмерные структуры изоформ ФСГ: чФСГ-24, чФСГ-21, чФСГ-18 и чФСГ-15 соответственно [10]
женщин в период постменопаузы, доминантной изоформой является чФСГ-24, которая составляет примерно 80%, в то время как частично гликозилированный чФСГ-21 составляет 52–70% в образцах, выделенных из гипофиза женщин репродуктивного возраста. Несмотря на то, что причины переключения с гипогликозилированной гликоформы чФСГ-21 на полностью гликозилированную чФСГ-24 в настоящее время до конца не изучены, исследования свидетельствуют о влиянии разных профилей гликозилирования ФСГ на клинические исходы у пациентов, проходивших лечение от бесплодия [11].
В исследованиях показан различный вклад каждой из углеводной компоненты в ту или иную биологическую функцию ФСГ. Например, в то время как углеводные остатки α-субъединицы участвуют в фолдинге, стабильности как субъединицы отдельно, так и в составе гетеродимера, способствуют полной активации рецептора ФСГ, ФСГ-Р (FSHR от англ. Follicle Stimulating Hormone Re- ceptor), а также участвует в модулировании связывания ФСГ с рецептором, гликаны β-субъединицы играют большую роль в метаболизме ФСГ и, таким образом, в периоде выведения из кровеносного русла. В частности, удаление углеводов β-субъединицы влияет на сборку β- и α-субъединиц, что приводит к потере активности гормона и секреции in vivo, а гипогликозилированный чФСГ, представляющий собой смесь сложно химически разделимую чФСГ-21 и чФСГ-18 (чФСГ-21/18), характеризуется в 9–26 раз большей активностью, чем полностью гликозилированная гликоформа чФСГ-24. В то же время полностью дегликозилированная изоформа чФСГ демонстрировала большую биологическую активность в условиях in vitro, чем тетрагликозилированная форма гормона [6]. Более детально об участии каждой из углеводной части ФСГ в связывании молекулы с рецептором, стабильности, каскаде передачи сигнала и т.д. изложено в статье [9].
Микрогетерогенность
Под микрогетерогенностью понимается характеристика уникальных олигосахаридных структур ФСГ, которые могут отличаться по количеству углеводных остатков, качественному составу и степени разветвленности углеводных частей молекулы. Таким образом, в результате явления микро-гетерогенности биоразнообразие форм ФСГ насчитывает по разным оценкам от 80 до 100 и более уникальных олигосахаридных структур.
В то время как при O-связанном гликозилировании, при котором характерно присоединение углеводного остатка N-ацетилгалактозамина к ОН-группе радикала аминокислотного остатка треонина или серина белковой части молекулы, N-связанное гликозилирование гликопротеинов модифицирование, как было упомянуто ранее, происходит по амидным группам аспарагина присоединением N-ацетилглюкозамина. Затем связующий углеводный остаток в молекулах гонадотропинов претерпевает дальнейшую модификацию путем добавления других углеводных остатков в том числе с формированием би-/три-/тетраантенных разветвленных структур, а также присоединением остатков сиаловой кислоты (сиалирование) или сульфоновой группы (сульфатирование). Данные модификации играют большую роль в модуляции биологической активности, а также в метаболизме гликопротеинов. Количество остатков сиаловой и сульфоновой кислот предопределяют суммарный заряд углеводной части молекулы, что отображается в значении изоэлектрической точки (pI, от англ. isoelectric point) всей гликоформы чФСГ. Помимо влияния суммарного заряда на скорость выведения посредством клубочковой фильтрации, десиалированные формы чФСГ быстрее выводятся из циркуляции в организме человека также при участии так называемого асиалогликопротеинового рецептора лектиновой природы (ASGPR, от англ. Asialoglycoprotein receptor). Асиалогликопротеиновый рецептор находится на клетках печени и удаляет из кровеносного русла десиалированные гликопротеины с концевыми экспонированными углеводными остатками D-галактозы в невосстановленной форме или N-ацетилгалактозамина. Таким образом, степень сиалированности играет большую роль во времени полувыведения чФСГ в плазме крови, а значит, в эффективности и биологической активности гормона [12]. Углеводные компоненты чФСГ на 85–98% относятся к
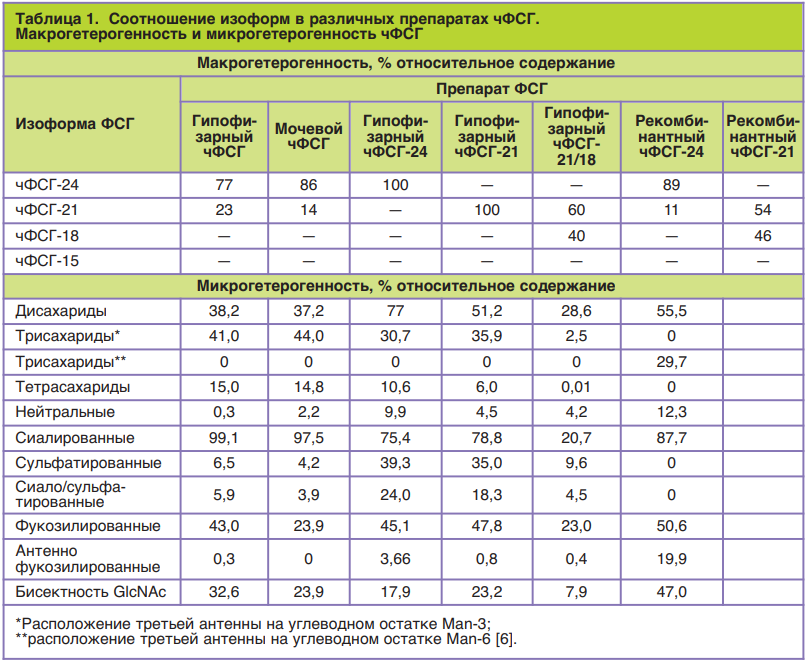
комплексному типу, 36–46% – двухантенные трехантенные, 30–49% – триантенные, 5–15% – тетра- антенные; степень сиалированности составляет 88–99% и только 4–7% – сульфатированные формы (табл. 1). Низкая степень сульфатирования олигосахаридов, по-видимому, является видоспецифической для человека характеристикой, поскольку препараты ФСГ крупного рогатого скота, свиней, овец и лошадей содержат более высокие уровни сульфатированных олигосахаридов (13–58%) [6]. Забегая вперед, стоит отметить, что рекомбинантные аналоги чФСГ (р-чФСГ) характеризуются меньшей степенью разветвленности углеводной части молекулы: большая часть (55%) представлена биантенными гликанами. Тем не менее степень сиалированности р-чФСГ не сильно меньше мочевых препаратов ФСГ, даже несмотря на большее количество три- и тетраантенных комплексов [6].
Механизм действия ФСГ. Рецептор ФСГ
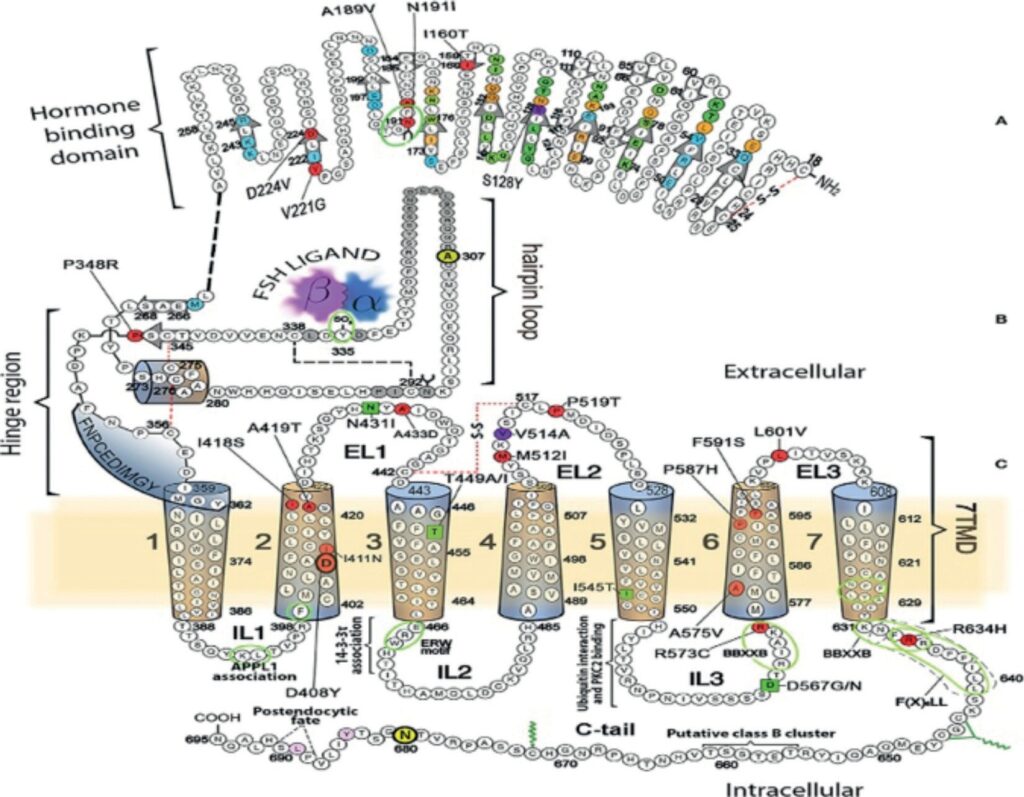
Механизм действия ФСГ опосредован с рецептором ФСГ, ФСГ-Р, который относится к суперсемейству рецепторов, сопряженных с G-белком (англ. G-protein-coupled receptors, GPCRs). В отличие от большинства GPCR, ФСГ-Р, как и рецептор ЛГ/ХГЧ, характеризуется значительным по размеру внеклеточным доменом (эктодоменом), который содержит 340–420 аминокислотных остатка. Эктодомен включает два функциональных домена: жесткий N-концевой гормоносвязывающий домен, который характеризуется большим количеством повторов с высоким содержанием аминокислотных остатков лейцина, образующий так называемый LLR-домен (от англ. leucine-rich repeat) и шарнирный домен (рис. 5). LLR-домен обеспечивает высокоаффинное связывание ФСГ с лигандосвязывающим сайтом эктодомена. Таким образом, эктодомен участвует в активации рецептора
Рис. 5. Схематичное изображение ФСГ-Р. А – гормонспецифический связывающий домен. Остатки, расположенные в высокоаффинном сайте связывания, представлены цветными кружками: связывающиеся только с α-субъединицей ФСГ выделены зеленым, только с β-субъединицей ФСГ – синим; с обеими субъединицами ФСГ – оранжевым. Мутации в остатках, приводящие к потере функции
ФСГ-Р, окрашены в красный цвет. Шарнирный участок (B), участвующий в связывании с ФСГ, обозначен зеленым овалом. C – семь трансмембранных участков из α-спиралей представлены в виде цилиндров [13]
при связывании рецептора с лигандом, тогда как трансмембранный домен связан с активацией рецептора и передачей сигнала. Шарнирная область всех гликопептидных гормонов участвует в связывании лиганда с высокой аффинностью, а также в активации рецептора, внутримолекулярной передаче сигнала и подавлении базальной активности рецептора в отсутствие лиганда.
Ключевую роль в высокоаффинном и специфичном связывании играет сульфатированный по ОН-группе аминокислотный остаток тирозина в шарнирной области рецептора ФСГ (Tyr335). Отрицательно заряженная сульфогруппа, расположенная в нижней части ФСГ-связывающего кармана рецептора, стабилизирует конформацию гормона, необходимую для эффективного связывания с ФСГ-Р через систему водородных связей с амидными группами в составе аминокислотных остатков α- и β-субъединиц ФСГ. Близкое расположение положительно заряженной амидной группы аргинина в положении 35 (Arg35) β-субъединицы и сульфатированного тирозина Tyr335 приводит к усилению электростатического взаимодействия, что в итоге инициирует изменение заряда и конформации ФСГ-Р, что в конечном счете через изменение пространственной структуры спейсерного участка эктодомена приводит к активации рецептора.
Рис. 6. Схема молекулярных путей активации клетки через рецептор ФСГ [13]
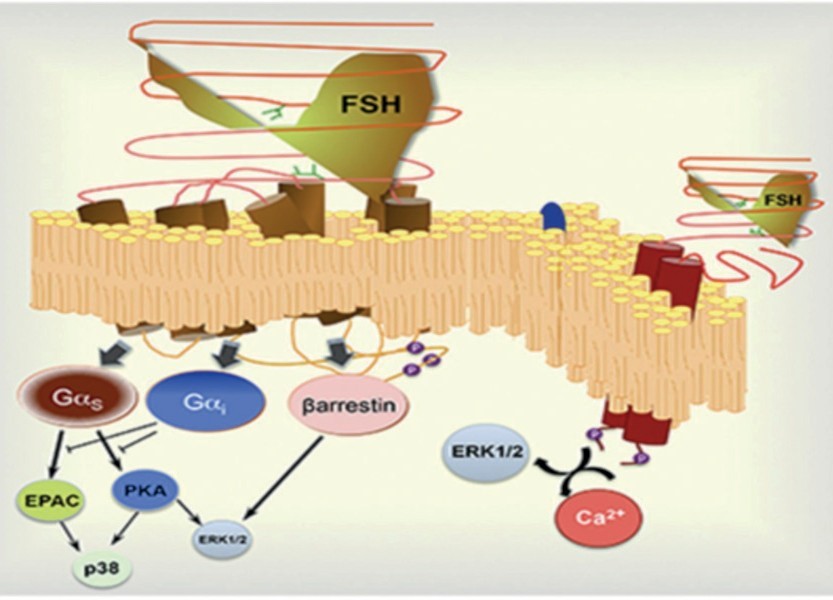
Связывание ФСГ с рецептором ФСГ-Р приводит к активации сразу нескольких сигнальных каскадов, которые активируются либо параллельно, либо последовательно: каскад, стимулирующий активность аденилатциклазы (АЦ) через Gs-белки, каскад, ингибирующий активность АЦ через Gi/o-белки, фосфолипазный каскад через Gq/11-белки и аррестиновый путь через регуляторные белки β-аррестины. Основным является аденилатциклазный сигнальный каскад, тем не менее, наряду с перечисленными активируемыми связыванием лиганда с рецептором, ФСГ вызывает также стимуляцию ряда важнейших эффекторных белков, включая MAPK – ERK ½ и p38 MAPK [14].
Канонический сигнальный аденилатциклазный путь является одним из универсальных для всех типов G-белок связанных рецепторов и высококонсервативен в системе передачи сигнала у эукариот. После активации рецептора при связывании лиганда происходит активация Gαs-субъединицы, которая активирует АЦ. Мембранно-связанный фермент расщепляет молекулу аденозинтрифосфата (АТФ) с образованием универсального вторичного посредника – циклического аденозинмонофосфата (цАМФ) и диацилглицерина (ДАГ). Повышение концентрации цАМФ внутри клетки ведет к активации протеинкиназы А, основной мишенью которой являются цАМФ-зависимые транскрипционные факторы, контролирующие экспрессию множества генов (рис. 6). Второй мишенью цАМФ являются факторы Epac, которые при связывании с цАМФ стимулируют обмен гуаниновых нуклеотидов в малых G-белках Rap-семейства, что приводит к активации гранулезных клеток и клеток поверхностного эпителия яичников [14].
ФСГ-Р активирует фосфорилирование ERK1/2 двумя различными путями, один из которых опосредуется Gαs-субъединицей, а другой β-аррестинами. Они способствуют десенсибилизации и интернализации фосфорилированного рецептора при высоком уровне связывания лиганда с рецептором. Кроме того, эти эффекторы также участвуют в регуляции внутриклеточной передачи сигналов посредством активации различных сигнальных каскадов. Когда стимулируется протеинкиназный А путь, фосфорилирование и активация ERK1/2 происходит быстро и является кратковременной, достигающей пика через 5–10 мин после воздействия ФСГ, в то время как при опосредованном β-аррестинами пути активация происходит медленнее, но более длительно по времени и в основном происходит в последующие 10–30 мин после воздействия агониста.
Влияние гетерогенности гликозилирования ФСГ на связывание с рецептором
Очевидно, что сложный последовательный процесс связывания и активации гормонорецепторного комплекса напрямую зависит от возможности эффективного связывания молекулы гормона рядом с активным центром рецептора. Таким образом, профиль гликозилирования ФСГ обеспечивает возможность приобретения должной конформации и экспонирование принципиально важных для связывания аминокислотных остатков вблизи активного центра ФСГ-Р. В частности, хорошо известно, что олигосахарид по аминокислотному остатку Asp52 α-субъединицы нужен для полной агонистической активности, и удаление олигосахарида резко снижает эффективность гормона [15]. Частично гликозилированные варианты ФСГ чФСГ-21/18 демонстрируют более высокие скорости связывания и большую аффинность, чем полностью гликозилированный чФСГ-24, что предопределяет большую биологическую активность гипогликозилированной формы [6]. Так, гипогликозилированный чФСГ немедленно связывается с ФСГ-Р, в то время как полностью гликозилированный чФСГ-24 имеет примерно 30-минутную задержку перед полным связыванием с рецептором [16], гипогликозилированный чФСГ-21/18 проявляет в 2,8–14 раз более высокое сродство к ФСГ-Р по сравнению с чФСГ-24. В дополнение гипогликозилированный чФСГ-21/18 в течение более длительного времени (в 2–3 раза) занимает сайт связывания в структуре ФСГ-Р, чем чФСГ-24 [17].
Поскольку выработка цАМФ при связывании лиганда с рецептором клетками-мишенями прямо про- порциональна длительности нахождения ФСГ в активном центре ФСГ-Р, ожидается, что более высокая аффинность гипогликозилированного чФСГ с ФСГ-Р обеспечит соответственно большую клеточную активацию, чем полностью гликозилированный чФСГ-24 [18]. Однако поскольку ФСГ-Р склонен к образованию тримерного комплекса, в отличие от большинства G-белок связанных рецепторов, образующих димеры, ФСГ-Р при этом может включать только один G-белок. Таким образом, маловероятно, что это поспособствует увеличению секреции цАМФ и как следствие увеличению биологической активности. Другая возможность увеличения биологической активности потенциального препарата ФСГ состоит в том, что гипогликозилированный ФСГ создает более стабильный комплекс с рецептором при сравнении с полностью гликозилированным чФСГ-24 [19]. Также существует возможность и того, что гипогликозилированный чФСГ тормозит диссоциацию комплекса ФСГ/ФСГ-Р с последующим возвращением рецептора на клеточную мембрану [20]. Таким образом, при моделировании молекулы ФСГ с учетом обозначенных ключевых моментов, влияющих на силу связывания, можно повлиять на динамическую стехиометрию занятых и свободных к связыванию с лигандом рецепторов на клеточной поверхности и, следовательно, рецептивность клетки-мишени.
Функции ФСГ
ФСГ – это гонадотропин, который стимулирует стероидогенез и гаметогенез в гонадах. Секретируемый передней долей гипофиза ФСГ регулирует менструальный цикл и созревание фолликулов яичников у женщин и участвует в стимуляции сперматогенеза у мужчин. ФСГ действует путем связывания с рецептором ФСГ (ФСГ-Р) на поверхности клеток гранулезы в яичниках и поверхности клеток Сертоли в яичках.
Экстрагонадная экспрессия рецепторов ФСГ
Несмотря на то что в течение многих лет считалось, что ФСГ-Р локализован исключительно в гонадах, недавние исследования показали, что ФСГ-Р присутствует также и в других тканях, где, предполагается, выполняет различные физиологические функции [21, 22]. ФСГ-Р локализован в остеокластах, моноцитах, эндотелиальных клетках пупочной вены, клетках опухолей, тканях женской репродуктивной системы, развивающейся плаценты и печени. Недавно предположили, что роль ФСГ-Р в ткани печени заключается в том, что ФСГ может участвовать в экспрессии рецептора липопротеинов низкой плотности и в регуляции клиренса холестерина липопротеинов низкой плотности [23]. Дальнейшие исследования необходимы для более четкого выяснения экспрессии и физиологического значения ФСГ-Р в различных тканях, а также для установления структурного сходства с гонадным ФСГ-Р, если они представляют собой сплайсинговые варианты гена рецептора, к примеру.
Применение ФСГ для лечения бесплодия
Биологическая активность гонадотропинов уже длительное время с успехом используется для лечения бесплодия. Исторически первые препараты ФСГ представляли собой экстракты гипофизов животных и человека. Стимуляция фолликулов у женщин была предпринята еще в 1931 г. с использованием гонадотропинов сыворотки беременных кобыл (PMSG, от англ. Pregnant Mare’s Serum Go- nadotropin), однако вскоре обнаружили, что после одной-двух стимуляций таким препаратом развивается невосприимчивость к гормонам ввиду образования нейтрализующих антител, «антигормо-
Рис. 7. Хронология истории изучения ФСГ и его препаратов.
чМГ – менопаузальный гонадотропин человека; р-ХГЧ – рекомбинантный ХГЧ; р-чФСГ – рекомбинантный чФСГ; р-чЛГ -рекомбинантный лютеинизирующий гормон человека; чГГ – человеческие гипофизарные гонадотропины; ВОЗ – Всемирная организация здравоохранения; ЕС -Евросоюз; ЭКО -экстракорпоральное оплодотворение
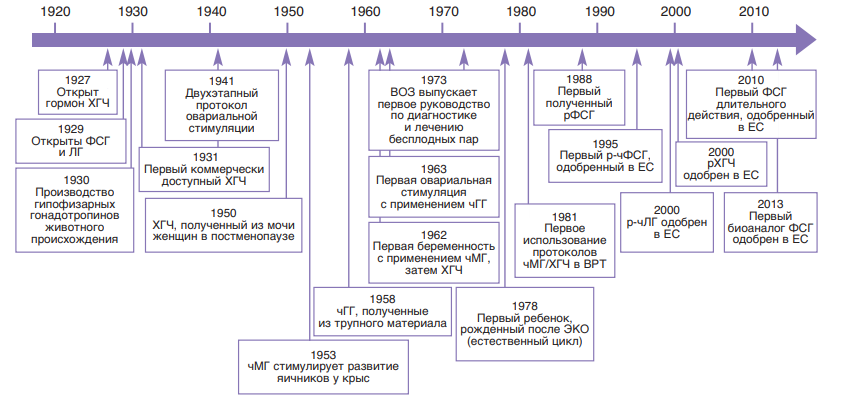
нов», которые нейтрализовали гонадотропины не только экзогенного, но и эндогенного происхождения [24, 25]. Альтернативный источник гонадотропинов в виде экстракта из гипофиза погибших людей был предложен в 1958 г. и обладал целым рядом недостатков. Так, помимо ограничений в количестве источника сырья, при использовании подобных препаратов существует риск развития болезни Крейтцфельда–Якоба. Выявленные случаи этого заболевания у женщин, получавших гонадотропины и гормон роста трупного происхождения в Австралии, Великобритании и Франции, стали причиной полного запрета с 1990 г. всех препаратов, сырьем для получения которых служат постмортальные ткани человека и животных (рис. 7) [24].
Работы по получению гонадотропинов из мочи женщин в период постменопаузы, содержащей высокие концентрации ЛГ и ФСГ, были более успешны. В 1949 г. итальянский химик P. Donini для очистки гонадотропинов от мочевых примесей предложил использовать метод фильтрации. Несмотря на то что биологическая активность полученного препарата не превышала 5% (остальные 95% приходились на белковые примеси), он получил название менотропина, или человеческого менопаузального гонадотропина (ЧМГ). В 1959 г. состоялась первая апробация очищенного экстракта ЧМГ на людях, а к 1962 г. получили три беременности, наступившие в результате стимуляции роста фолликулов препаратом Пергонал®. Существенным недостатком ЧМГ являются высокие концентрации ЛГ, активность которого негативно сказывается на результатах стимуляции, а также большое содержание примесей белковой природы в моче. В связи с этим дальнейшее развитие препаратов ФСГ заключалось в попытках разработать методику очистки, позволявшую максимально удалить ЛГ и мочевые белковые примеси из готовой субстанции. Поставленная цель была достигнута введением этапа иммуноаффинной очистки после фильтрации. Использование поликлональных антител на эта- пе иммуноаффинной очистки положило начало второму классу мочевых гонадотропинов – урофолли- тропинов, первые роды с применением которого в рамках клинических испытаний были получены в 1980 г. [24]. Использование моноклональных антител на этапе иммуноаффинной очистки позволило увеличить чистоту препаратов ФСГ до 95%, которые считаются третьим классом гонадотро-
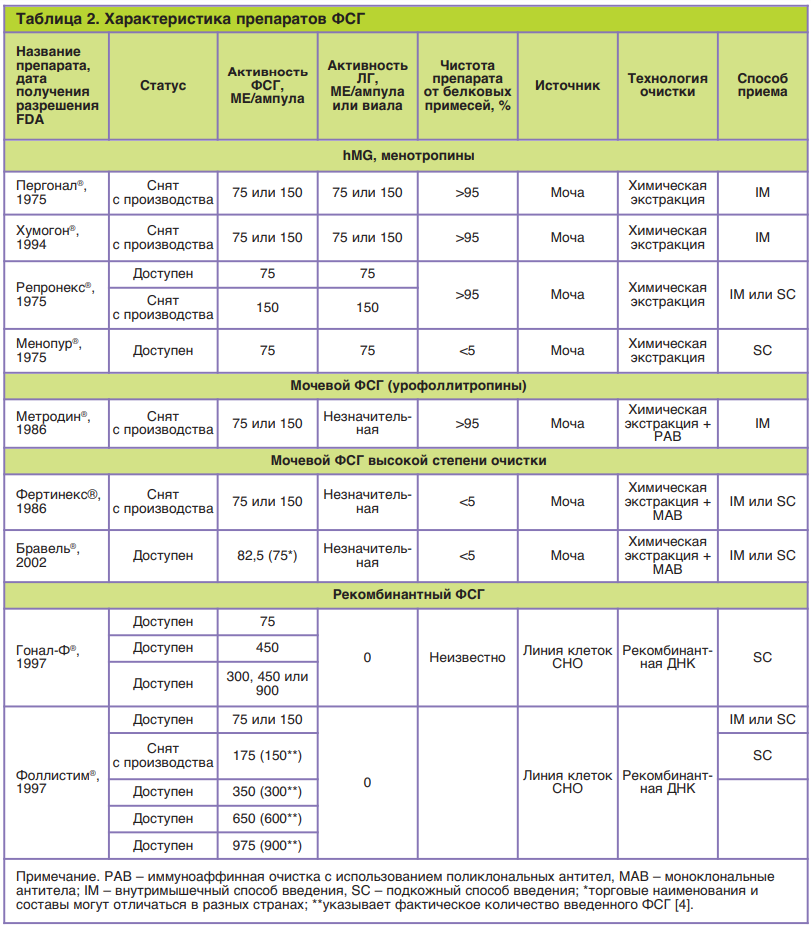
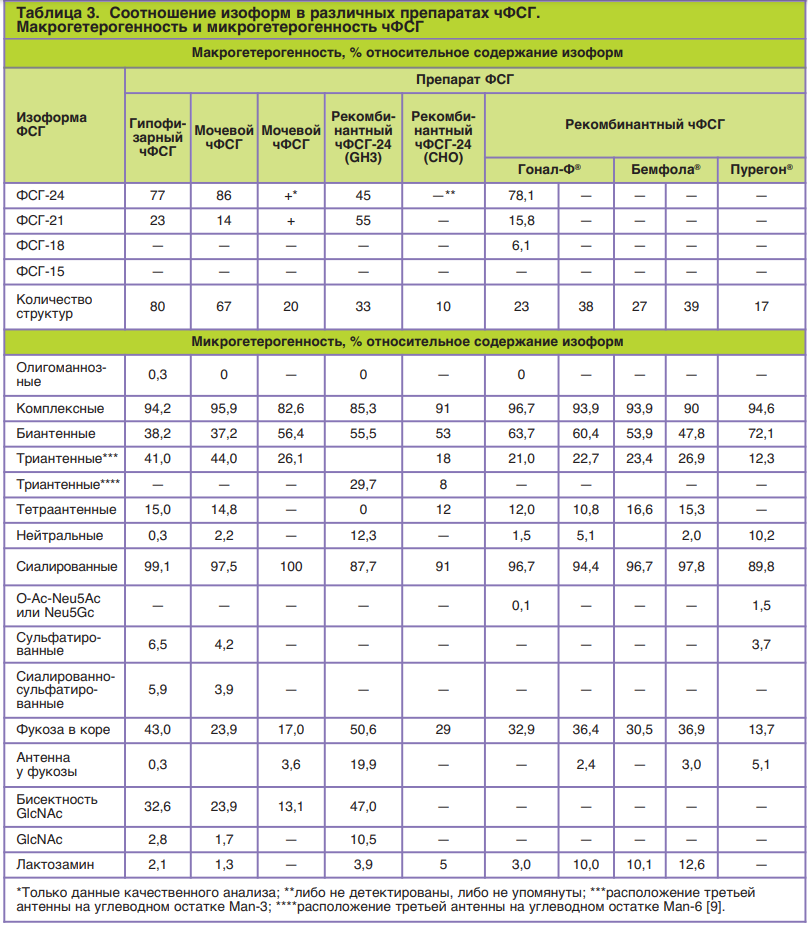
пинов – урофоллитропины высокой степени очистки (табл. 2). В табл. 3 представлены сравнительные данные по особенностям гликозилирования чФСГ в различных препаратах.
Несмотря на использование урофоллитропинов высокой степени очистки в настоящее время в рамках лечения бесплодия, подобные препараты имеют также ряд недостатков: ограничения в источниках сырья и количестве доноров, изменчивость содержания ФСГ и ЛГ от партии к партии, и т.д. Большинство из перечисленных недостатков удалось преодолеть с развитием рекомбинантных технологий. В рамках данной части литературного обзора рассмотрим рекомбинантные препараты ФСГ более подробно.
Рекомбинантные гонадотропины (сравнительная характеристика)
В настоящее время разработка препаратов чФСГ с использованием рекомбинантных технологий ведется по двум направлениям: без внесения модификаций в аминокислотную последовательность и с дополнительными модификациями белковой части чФСГ, которые, как правило, направлены на увеличение молекулярной массы молекулы, что в итоге увеличивает время циркуляции в кровеносном русле, а значит, и продолжительность действия (рис. 8).
Сегодня на рынке представлены три продукта р-чФСГ без модифицирования белкового остова гормона: фоллитропин альфа, фоллитропин бета и фоллитропин дельта; фоллитропин эпсилон находится в стадии подготовки к выходу на терапевтический рынок [26]. Фоллитропин альфа и фолли-
Рис. 8. Основные подходы к получению препаратов чФСГ

тропин бета получают с помощью клеточных линий яичника китайского хомячка CHO (от англ. Chi- nese Hamster Ovary), которые стали первыми рекомбинантными молекулами чФСГ (р-чФСГ), получившие одобрение для применения в терапевтических целях при лечении бесплодия в 1995 г. – фоллитропин альфа и в 1996 г. – фоллитропин бета. Впоследствии были разработаны рекомбинантные ЛГ и ХГЧ, а также биоаналоги фоллитропина альфа, которые были внедрены в клиническую практику. Исторически более поздние аналоги р-чФСГ, фоллитропин дельта и фоллитропин эпсилон, разработаны с использованием линий клеток другого биологического вида – линий клеток человека. Все перечисленные р-чФСГ имеют аминокислотную последовательность, идентичную последовательности эндогенного чФСГ, который характеризуется довольно коротким периодом полувыведения (около 1 дня), что требует ежедневного приема. Для удобства применения создан препарат более длительного действия с периодом полувыведения 70 (59–82) ч, получивший название корифоллитропин альфа и выпускающийся под торговым названием Элонва®.
По сравнению с углеводными компонентами природных препаратов чФСГ гликаны рекомбинантных препаратов ФСГ имеют меньшую степень разветвления и состоят в основном (55%) из двухантенных гликанов. Тем не менее степень сиалилирования в этих препаратах отстает от уровня мочевого чФСГ незначительно, потому что наиболее распространенные трехантенные и тетраантенные гликаны мочевого ФСГ имеют по одному остатку сиаловой кислоты.
Фоллитропин альфа и фоллитропин бета
Изначально фоллитропин альфа (торговое название Гонал-Ф®, Merck) был разработан фирмой Serono, являющейся предшественницей Merck, в 1988 г. и получил лицензию на маркетинг для клинического применения как у женщин, так и у мужчин в 1995 г. в Европе и в 2004 г. в США. Позже стали доступны несколько биоаналогов фоллитропина альфа с торговыми названиями Бемфола® (Afolia) и Овалип® (Teva), которые к настоящему времени одобрены только в Европе, но не одобрены в США. Фоллитропин бета (торговое название Пурегон®, Merck & Со) получил разрешение на маркетинг в 1996 г. в Европе и в 2004 г. в США (Фоллистим AQ).
Фоллитропин альфа и фоллитропин бета продуцируются в клетках китайского хомячка. Генетические векторы, плазмиды – кольцевые структуры с последовательностями генов, кодирующие чФСГ, а также включающие ряд регуляторных элементов, используемые для получения фоллитропинов альфа и бета, а также процесс очистки целевого продукта, различаются. В связи с этим молекулы фоллитропинов альфа и бета имеют некоторые различия в паттернах гликозилирования, ввиду чего изоэлектрическая точка (pI) фоллитропина альфа ниже и имеет более узкий диапазон значений, чем у фоллитропина бета: 4–5 и 3,5–5,5 соответственно. Кроме того, фоллитропин альфа содержит меньше изоформ со значением изоэлектрической точки ниже 4 (9 и ~24% соответствен- но) [27]. Эти различия приводят к тому, что фоллитропин альфа имеет более кислые значения рН, а фоллитропин бета, таким образом, является более основным, что в конечном счете предопределяет различия в фармакокинетике фоллитропинов альфа и бета [28]. К примеру, средняя специфическая активность р-чФСГ между фоллитропином альфа и фоллитропином бета различается в 2–3 раза, ввиду чего количество белка, необходимое для создания рабочей концентрации (дозы), разное. Фоллитропин альфа первоначально дозировался в международных единицах (МЕ) на основании его биологической активности в тесте Стилмана–Поли (Sleelman–Pohley) с использованием крыс в качестве модельной системы. Со временем стабильность состава препарата позволила установить удельную активность, которая представляет собой отношение биологической активности (МЕ) к содержанию белка (мг). Таким образом, фоллитропин альфа стало возможно дозировать по массе, что, согласно полученным результатам исследований, позволяет получить более выраженную реакцию яичников, снижение частоты отмены пункции, а также возможность корректировать дозу в течение цикла и повторного мониторинга [29].
Несмотря на различия между фоллитропином альфа и фоллитропином бета, результаты клинических и ретроспективных исследований, сравнивающих два продукта для стимуляции яичников у женщин в циклах экстракорпорального оплодотворения (ЭКО), не показали существенных различий между препаратами с точки зрения эффективности или безопасности [30]. Баланс риск/польза для фоллитропинов альфа и бета считается положительным, при этом основными побочными эффектами являются головная боль, кисты яичника, кожные реакции в месте введения препарата, возможность развития синдрома гиперстимуляции яичников (СГЯ) в легкой или умеренной форме. Различия в гликозилировании белковой молекулы гормона наблюдаются также между биоаналогами фоллитропинов (строение и размер радикалов, степень сиалилирования) и как результат – более высокая вариабельность в активности между партиями по сравнению с оригинальными препаратами. Согласно руководствам Европейского медицинского агентства (EMA), которые рекомендуют для определения клинически сопоставимой эффективности эталонного и аналогичных биологических препаратов проводить оценку числа получаемых ооцитов (как первичная конечная точка) и частоты СГЯ как неблагоприятную реакцию особого интереса в рандомизированных клинических исследованиях с параллельными группами пациентов [31], подобные различия биоаналогов по сравнению с оригинальными препаратами регулирующие ведомства оценили как незначительные и приемлемые. Однако наблюдаемые различия в свойстве препаратов могут иметь биологические последствия, в том числе влиять на рецептор ФСГ, особенно у «неидеальных» пациентов: старшей возрастной группы, со слабым или неоптимальным ответом яичников на стимуляцию, а также при наличии других факторов риска [32].
Фоллитропин дельта
При получении гормонов белковой природы, таких как чФСГ, повлиять на профиль гликозилирования можно подбором наиболее оптимальной системы экспрессии, которая обладает комплексом ферментов, способных к последовательному синтезу и изомеризации сахарных остатков. Ввиду большого разнообразия состава гликозидных остатков в природных гормонах развитие технологий на данный момент не позволяет определить универсальный набор ферментов для гликозилирования в системе экспрессии. Возможным решением для получения наиболее близкого к природному паттерну гликозилирования чФСГ является использование культуры клеток человека. В настоящее время появились два новых терапевтических соединения ФСГ, продуцируемые клеточными линиями человека: фоллитропины дельта и эпсилон. Эти препараты несколько отличаются по характеру гликозилирования и, по-видимому, демонстрируют более благоприятный фармакологический профиль, чем рекомбинантные препараты, синтезированные клеточными линиями, не принадлежащими человеку [33–35]. Новые препараты р-чФСГ могут иметь лучший профиль эффективность/ безопасность, чем уже широко используемые соединения ФСГ, полученные при использовании систем экспрессии, в которых клетки-продуценты не относятся к человеческим клеточным линиям, особенно у женщин с менее благоприятным прогнозом.
Культура неизмененных (не опухолевых) клеток человека, в частности линия клеток человека из клеток сетчатки плода человека PER.C6, которая используется для получения фоллитропина дельта, обладает наибольшим потенциалом для синтеза аналога природного чФСГ с высоким качественно-количественным сходством гликозилирования (по степени сиалилирования, паттернам ветвления, макрогетерогенности). Данная линия для использования в качестве системы экспрессии подобрана так, чтобы продукт имел профиль гликозилирования наиболее близкий к нативному чФСГ: более высокую долю три- и тетрасиалилированных гликанов, сиалилирование, наличие α2,3- и α2,6-гликозидных связей за счет коэкспрессии комбинированной активности двух сиалил- трансфераз – ST3 и ST6.
Препарат фоллитропин дельта (торговое название Рековелль®, Ferring Pharmaceuticals) разработан с целью повышения безопасности гормонального продукта путем устранения межвидовых вариаций посттрансляционной модификации белка за счет использования в качестве синтетической базы для продукции гормона культуры клеток человека (клетки сетчатки плода человека PER.C6). Препарат Рековелль® получил лицензию на маркетинг в Европе в 2016 г. Он отличается по характеру гликозилирования от фоллитропина альфа и фоллитропина бета содержанием более высокой доли три- и тетрасиалилированных гликанов, чем фоллитропин альфа, а также наличием α2,3- и α2,6-гликозидных связей при присоединении остатков сиаловой кислоты, тогда как фоллитропин альфа имеет только один тип (α2,3). Различные фармакокинетические и фармакодинамические данные (биодоступность, клиренс и индукция синтеза, вариант изоформы эстрадиола, созревание яйцеклеток, побочные эффекты) при сравнении фоллитропина альфа и фоллитропина дельта свидетельствуют в пользу некоторых различий в свойствах этих двух продуктов при приеме женщинами в терапевтических целях, а также влияют на их эффективность для лечения бесплодия. В отличие от фоллитропина альфа биоактивность фоллитропина дельта не может оцениваться при проведении теста Стилмана–Поли ввиду получения стандарта в другой системе экспрессии (СНО) и, соответственно, отличным профилем гликозилирования, который является эталонным. Это выражается в более быстром клиренсе фоллитропина дельта у крыс по сравнению с фоллитропином альфа (происхождение из клеток грызунов), что приводит к снижению фиксируемой активности в тесте с использованием животных в качестве биологической модели. Сразу стоит ответить, что такого эффекта (быстрого клиренса) у человека не наблюдается. Это подтверждает невозможность применения животных в качестве модельных систем для оценки биологической активности фоллитропинов, полученных с использованием клеточных линий человека, и такие препараты могут быть дозированы только по массе (в мкг). Кроме того, фармакологические различия между фоллитропином дельта и фоллитропином альфа позволяют предположить, что эти препараты не могут быть рутинно заменены друг другом в клинической практике, например в ходе одного или нескольких последовательных протоколов ВРТ. Данные различия обусловлены особенностями углеводной части фоллитропина дельта. Для сравнения в табл. 4 приведены некоторые характеристики углеводных частей чФСГ рекомбинантных и природного происхождения.
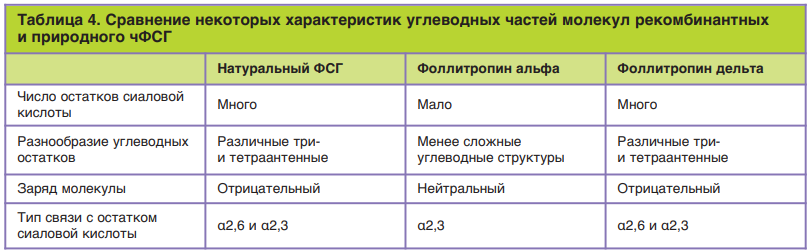
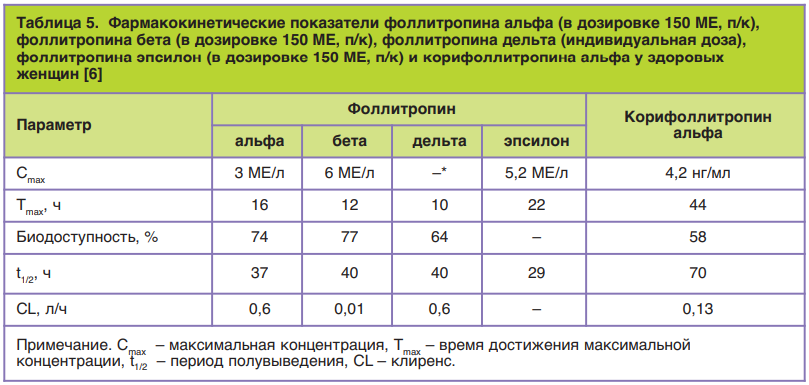
Рис. 9. Частота развития СГЯ при проведении стимуляции суперовуляции

Особенности углеводной части фоллитропина дельта объясняют зафиксированные различия в фармакокинетике (табл. 5).
Ускоренное выведение фоллитропина дельта у грызунов может объясняться участием ASGP в ге- патоцитах печени животных, что активно способствует катаболизму р-чФСГ. В гепатоцитах человека плотность этого рецептора сравнительно низкая, поэтому молекула фоллитропина дельта, минуя печень, направляется к клеткам-мишеням репродуктивной системы.
Поскольку применение лекарственных препаратов пептидной природы несет в себе риск аллергической реакции, всегда проводится оценка риска развития реакций со стороны иммунной системы. Известно, что чем меньше различий вводимой молекулы с природным лигандом (гормоном), тем риск развития иммунной реакции ниже. Проверка наличия антител против ФСГ у женщин после введения фоллитропина дельта продемонстрировала высокий профиль безопасности этого препарата: 1,1% в первом цикле стимуляции, 0,8 и 1,1% – в последующих двух. Более того, обнаружены очень низкие титры антител и без нейтрализующей способности. Повторное лечение фоллитропином дельта пациентов с анти-ФСГ-антителами (ранее существовавшими или индуцированными лечением) не увеличивало титр антител и не снижало ответ яичников. Исследования показали положительное соотношение риск/польза у фоллитропина дельта, а наиболее частыми побочными реакциями, о которых сообщалось в ходе клинических испытаний, были головная боль, дискомфорт в области таза, СГЯ, боль в области таза, тошнота, усталость (рис. 9) [36].
Фоллитропин эпсилон
Фоллитропин эпсилон (ФСГ-GEX; Glycotope) представляет собой рекомбинантный чФСГ, полученный с использованием линии клеток крови человека, выведенной из линии клеток миелоидного лейкоза, в настоящее время коммерчески недоступен [35]. Используемая клеточная линия продуцирует фоллитропин со значительными искажениями углеводной части молекулы – отмечены увеличенные размеры антенн, сильное фукозилирование и т.д. [37]. Такое изменение гликозилирования белковой молекулы сопровождается увеличением фармакодинамической активности препарата (сказывается на росте фолликулов и концентрации ингибина B в сыворотке крови) при неизменных фармакокинетических характеристиках (клиренс). Учитывая тот факт, что биологической активности фоллитропина альфа вполне достаточно для использования его в ВРТ, и целью поиска новых путей получения фоллитропина является повышение его безопасности, фармакодинамическое преимущество фоллитропина эпсилон утрачивается. Кроме того, использование линии опухолевых клеток человека позволяет получить большие количества белковой массы, однако особенности метаболического аппарата опухолевой клетки ставят под вопрос текущую и отсроченную безопасность применения продукта подобного происхождения для лечения бесплодия. Возможно, это стало причиной отсутствия данных о результатах III фазы клинических испытаний фоллитропина эпсилон в общедоступных источниках.
Корифоллитропин альфа
Из-за короткого периода полувыведения ранее рассмотренные препараты р-чФСГ необходимо вводить ежедневно, что может быть неудобно или даже неприемлемо для пациентов с учетом инвазивности способа приема, а также температурного режима хранения препаратов. Поэтому разработка препаратов пролонгированного действия рекомбинантного происхождения является крайне актуальной задачей [38]. Единственный одобренный на данный момент р-чФСГ пролонгированного действия (корифоллитропин альфа, торговое название Elonva®, Merck) разработан путем добавления карбоксотерминального пептида (CTP, от англ. C-terminal peptide) β-субъединицы ХГЧ к β-субъединице чФСГ, который включает четыре дополнительных сайта гликозилирования. Данная модификация увеличивает период полувыведения р-чФСГ без влияния на сборку с α-субъединицей, секрецию и т.д. [39]. Корифоллитропин альфа получил одобрение на маркетинг в 2010 г. в Европе для применения у женщин, проходивших лечение от бесплодия, но не одобрен для использования при лечении бесплодия у мужчин, а также не имеет регистрации в США. Баланс между риском и пользой корифоллитропина альфа считается положительным, при этом наиболее частыми побочными реакциями во время клинических испытаний были дискомфорт в области малого таза, СГЯ, головная боль, боль в области таза, тошнота, усталость и болезненность молочных желез. Поскольку он имеет в два раза более длительный период полувыведения и почти в 4 раза более длительный пик максимальной концентрации в сыворотке крови, чем другие доступные препараты р-чФСГ, корифоллитропин альфа можно одноразово вводить в виде одной подкожной инъекции, которая может заменить ежедневные инъекции других препаратов р-чФСГ в первые 7 дней стимуляции, что значительно упрощает лечение. Метаанализ доступных результатов клинических исследований, сравнивающих корифоллитропин альфа и ежедневные инъекции р-чФСГ у женщин при лечении бесплодия, не выявил существенных различий в частоте живорождения, продолжающейся беременности и наступления клинической беременности [40]. Имеются данные о снижении частоты живорождений (первичная конечная точка) у женщин, получавших низкую дозу (от 60 до 120 мкг) р-чФСГ длительного действия по сравнению с ежедневным введением р-чФСГ. Значительного увеличения риска развития СГЯ не наблюдалось, однако большее количество ооцитов получали при стимуляции корифоллитропином альфа, чем другими препаратами р-чФСГ, и была более высокая частота отмены переноса эмбриона в свежем переносе из-за чрезмерной стимуляции корифоллитропином альфа [38]. Для оценки безопасности и эффективности р-чФСГ длительного действия при применении у женщин с потенциальным низким и высоким ответом яичников, а также другими причинами нарушения репродуктивной функции необходимы дополнительные исследования.
Другие подходы для увеличения периода полувыведения р-чФСГ заключаются также в увеличении молекулярной массы молекулы за счет присоединения Fc-домена иммуноглобулина класса G (IgG), добавление новых сайтов гликозилирования и удлинение N-конца субъединиц р-чФСГ путем присоединения двух копий N-сцепленных последовательностей гликозилирования между α- и β-субъединицами чФСГ, с созданием одноцепочечного аналога «сшитого» гормона [41].
В рамках данного литературного обзора рассмотрим фармакокинетические и фармакодинамические характеристики фоллитропина дельта в качестве фармацевтического средства под торговым названием Рековелль® фирмы-производителя Ferring Pharmaceuticals более детально.
Фармакокинетика и фармакодинамика фоллитропина дельта
Фоллитропин дельта относится к фармакотерапевтической группе половых гормонов и модуляторов половой системы, к группе гонадотропинов, код АТХ: G03GA10.
Доклинические исследования
Фармакодинамические эффекты
В исследованиях in vitro показано, что константа аффинности (Ki) при связывании фоллитропина дельта с ФСГ-Р составляет 0,10 нМ, что эквивалентно константе аффинности фоллитропина альфа. В функциональном анализе с применением клеточной культуры, полученной из эмбриональных почек человека (HEK 293, от англ. Human Embryonic Kidney 293), с экспрессированным рецептором ФСГ-Р показано, что фоллитропин дельта действует как агонист рецептора с последующим накоплением внутриклеточного циклического аденозинмонофосфата (цАМФ) и передачей сигнала нижележащим рецепторам на поверхности культивируемых клеток гранулезы человека, сила сигнала сопоставима с фоллитропином альфа [42].
В исследовании Стилмана–Поли по оценке фармакодинамической эффективности in vivo с использованием крыс в качестве биологической модели показаны сопоставимые результаты по увеличению яичников при ежедневном введении препаратов фоллитропина альфа и дельта. Однако в первой фазе клинических исследований при приеме эквивалентных доз в МЕ по результатам исследований Стилмана–Поли у пациентов выявлены различные фармакодинамические эффекты: после введения Рековелль® наблюдался более выраженный ответ яичников (при оценке уровня эстрадиола, ингибина В и объема фолликулов) при сравнении с фоллитропином альфа. Разница в эффективности стимуляции производителем фоллитропина дельта объясняется различиями в паттернах гликозилирования различий в клеточных линиях, используемых для производства данных видов р-чФСГ. Биологическая активность фоллитропина дельта, дозированного по массе (в мкг), может быть оценена в исследованиях in vitro (в функциональном анализе на клеточных культурах) ввиду некорректной оценки в исследовании Стилмана–Поли с использованием крыс в качестве биологической модели.
Показано, что при приеме фоллитропина дельта количество полученных ооцитов увеличивается при увеличении дозировки препарата Рековелль® и концентрации АМГ в сыворотке крови пациентки. В то же время увеличение массы тела пациентки способствовало уменьшению количества получаемых ооцитов (клинически значимо только при дозировке Рековелль® ниже 12 мкг).
Фармакокинетические данные
Скорость всасывания оценивалась при подкожном введении фоллитропина дельта крысам и обезьянам в качестве биологических моделей. Показано, что фоллитропин дельта медленно всасывался у всех животных в исследовании: время достижения максимальной концентрации (Тmax) составляло от 4 до 8 ч у крыс и обезьян, в то время как у человека в аналогичном исследовании данный показатель составлял примерно 13 ч. Выявили, что период полувыведения из сыворотки у крыс был длительным и составил от 7 до 9 ч (у человека около 30 ч), а максимальная концентрация (Cmax) и общая экспозиция препарата в сыворотке крови и площадь под кривой зависимости концентрации от времени (AUC) у крыс зафиксированы больше, чем пропорционально дозе, и были увеличены при повторном дозировании, в то время как при введении обезьянам и человеку данные показатели были пропорциональны дозе [42]. Различный паттерн гликозилирования фоллитропинов альфа и дельта ввиду продукции препаратов с использованием клеточных линий разных биологических видов является логичным объяснением зафиксированным результатам исследований. В дополнение у мышей и крыс (но не людей) α2,6-сиалилирование связано с повышенной скоростью выведения гликопротеинов печенью посредством участия асиалогликопротеинового рецептора, что способствует более стремительному клиренсу фоллитропина дельта и, таким образом, снижению его эффективности в тесте Стилмана–Поли [42].
Доклинические данные по безопасности
Доклинические данные не указывают на особую опасность для человека, основанную на результатах традиционных исследований по фармакологии безопасности, токсичности (при введении многократных дозировок) и местной переносимости. Передозировка фоллитропина дельта привела к фармакологическому или чрезмерному фармакологическому действию. Фоллитропин дельта оказывал отрицательное влияние на фертильность и раннее эмбриональное развитие у крыс при введении в дозировке ≥0,8 мкг/кг на каждый киллограмм веса животного в сутки, что выше рекомендованной максимальной дозы для человека. Актуальность этих результатов для клинического использования Рековелль® ограничена.
Клинические исследования
Ввиду того, что тест Стилмана–Поли, который применяется для оценки биологической активности фоллитропинов альфа и бета, продемонстрировал невозможность своего использования для измерения биоактивности фоллитропина дельта, альтернативный подход расчета дозировки предполагал использовать массу фармацевтической субстанции. Были исследованы несколько показателей в качестве возможных параметров, на основании которых можно будет спрогнозировать ответ яичников в рамках контролируемой овариальной стимуляции (КОС) для расчета дозировки фоллитропина дельта. В качестве возможных таких биомаркеров рассматривали следующие параметры: сывороточная концентрация антимюллерова гормона (АМГ), ингибина В, масса тела и т.д. Наиболее значимыми параметрами для прогнозирования ответа яичников оказались АМГ и масса тела, о чем будет подробнее изложено ниже. В данной части литературного обзора детальнее рассмотрим физиологическую роль АМГ, изменения его концентрации в зависимости от возраста пациенток и их овариального резерва, а также методы количественного определения АМГ в сыворотке крови человека.
Антимюллеров гормон, АМГ
Антимюллеров гормон (АМГ) – это гликопротеин, который относится к суперсемейству белков, известных как суперсемейство трансформирующего ростового фактора, которое включает в себя активины, ингибины, антимюллеровы гормоны и т.д. Несмотря на историческое происхождение, название гормона из-за его участия в дифференцировке мужского пола вызывает регрессию мюллерова протока, на данный момент АМГ представляет собой один из самых объективных биомаркеров овариального резерва, с помощью которого производится оценка репродуктивного потенциала организма женщины, а также используется при диагностике синдрома поликистозных яичников (СПКЯ).
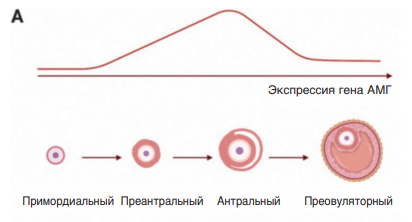
Экспрессия гена АМГ и, таким образом, концентрация АМГ зависит от фолликулогенеза и овариального резерва женщины (рис. 10). АМГ секретируется клетками гранулезы в малых и больших преантральных фолликулах, а также в малых антральных фолликулах диаметром до 8–10 мм. Экспрессия АМГ исчезает после ФСГ-опосредованной селекции фолликулов, хотя в некоторой степени она и отмечается в кумулюсных клетках преовуляторных фолликулов. С возрастом функциональный резерв яичников уменьшается в результате истощения пула примордиальных фолликулов. Это приводит к уменьшению количества мелких антральных фолликулов и как следствие к снижению уровня АМГ в сыворотке, достигая значений ниже пределов чувствительности соответствующих аналитических методик в период менопаузы.
Рис. 10. Изменение уровня экспрессии гена АМГ при созревании фолликула (А) и изменение концентрации АМГ в сыворотке крови на фоне снижения овариального резерва (В)
Исследования показали, что физиологическая роль АМГ заключается в препятствии преждевременной инициации роста примордиальных фолликулов и в блокировании действия ФСГ на антральные фолликулы во время гормоно-чувствительной фазы фолликулогенеза. Оба эти механизма препятствуют преждевременному истощению пула фолликулов в яичнике (рис. 11).
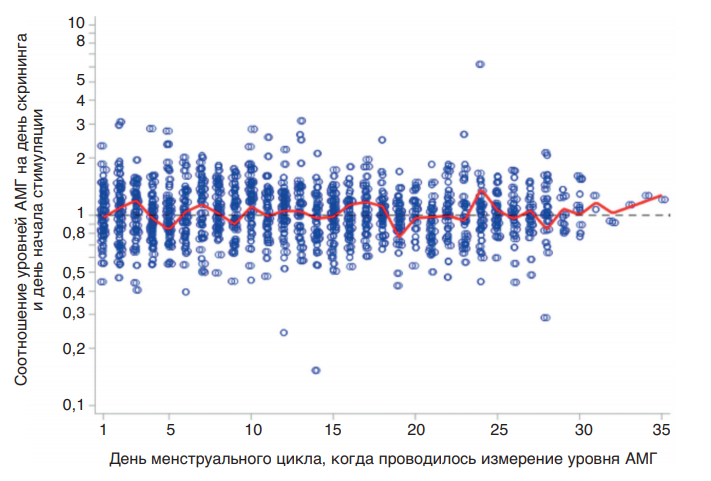
В отличие от других биомаркеров овариального резерва, таких как базальная концентрация эндогенного ФСГ в сыворотке крови и количество антральных фолликулов на 2–5-е сутки менструального цикла, АМГ характеризуется надежной предсказательной силой в любой день цикла ввиду минимальной вариабельности концентраций на протяжении менструального цикла, а также от цикла к циклу. В частности, в исследованиях [43–45] показано, что измерение уровня АМГ на любой день менструального цикла при скрининге, проведенное за 3 мес до вступления пациентки в протокол овариальной стимуляции, характеризовалось высокой корреляцией с аналогичным показателем на 2–3-й день менструального цикла непосредственно перед вступлением в протокол и мало зависело от дня цикла, когда это измерение было проведено изначально (рис. 12). Низкая вариабельность концентрации АМГ на протяжении всего цикла дополнительно подтверждена в рамках клинических исследований ESTHER-1 и ESTHER-2 (рис. 13), что дополнительно подтверждает релевантность использования концентрации данного гормона в сыворотке крови женщины в качестве показателя, отображающего ее овариальный резерв.
В исследовании [4] показано, что концентрация АМГ сохраняется не только ко 2–3-му дню первой стимуляции, но также сохраняется на протяжении нескольких последовательных циклов стимуляции:
Рис. 11. Физиологическая роль АМГ
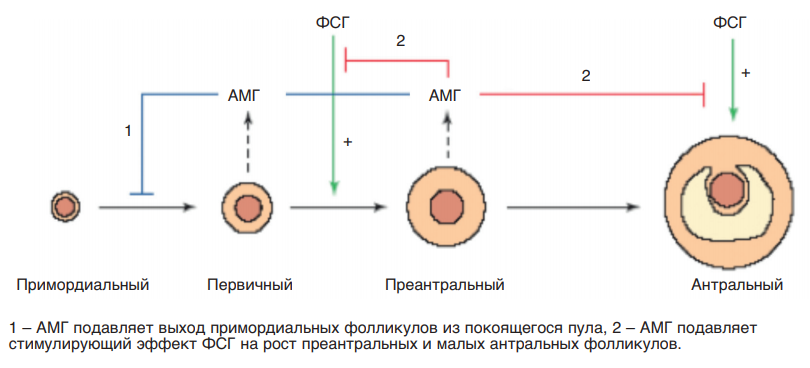
Рис. 12. Корреляция концентраций АМГ в сыворотке крови пациенток на момент сдачи анализов в рамках скрининга и на 2–3-й день первого цикла КОС [44]
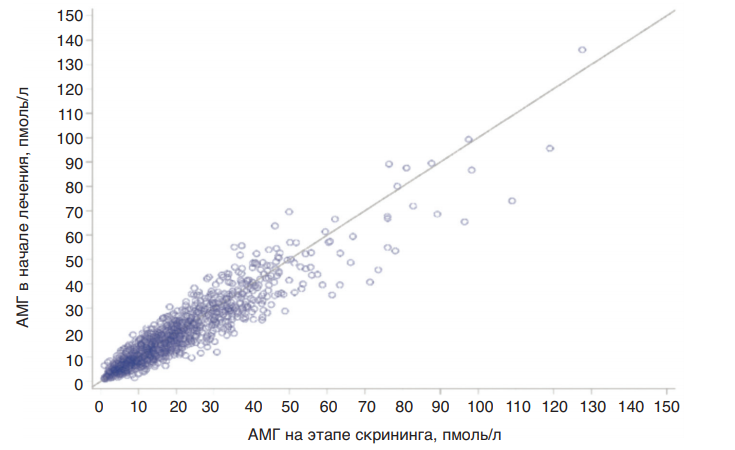
Рис. 13. Изменчивость уровня АМГ в различные дни менструального цикла и на начало овариальной стимуляции в рамках исследований ESTHER-1 и ESTHER-2 [44]
разница между полученными значениями остается недостоверной по крайней мере в течение одного года. Таким образом, концентрация АМГ характеризовалась достаточной стабильностью в течение года, что может быть использовано для подбора дозы ФСГ при контролируемой овариальной стимуляции (рис. 14).
В качестве альтернативного возможного предсказателя овариального резерва женщины, по которому можно разработать алгоритм расчета дозировки фоллитропина дельта, рассматривали число
Рис. 14. Соотношение сывороточных концентраций АМГ на день скрининга (независимо от дня менструального цикла) и на начало стимуляции [44]

антральных фолликулов. Серьезным ограничением использования данного параметра является его строгая зависимость от дня менструального цикла: подсчет количества фолликулов осуществляется на 2–3-й день цикла. К тому же в рамках рандомизированных контролируемых исследований (РКИ) концентрация АМГ в сыворотке крови характеризовалась лучшей корреляцией с числом полученных ооцитов после проведения овариальной стимуляции при сравнении с количеством антральных фолликулов в качестве предсказателя, что было подтверждено как в протоколах с использованием агонистов, так и антагонистов гонадотропин-рилизинг-гормона (ГнРГ; рис. 15).
Помимо низкой вариабельности внутри менструального цикла и от цикла к циклу дополнительные преимущества использования концентрации АМГ в качестве биомаркера овариального резерва заключаются в высокой надежности, высокой чувствительности, а также его высокой предсказывающей способности в ответе яичников в рамках стимуляции, включая клинические случаи с риском развития СГЯ. Ограничениями использования данного биомаркера овариального резерва являются отсутствие международного стандартизированного исследования, а также необходимость в бережном отборе проб и их хранении до момента анализа.
Отсутствие международного стандартизированного теста с низким показателем вариабельности является одним из основных ограничений четкого определения концентрации АМГ в сыворотке крови. Исторически до 2010 г. независимо были разработаны две платформы для иммуноферментного метода с использованием различных антител. Результаты, полученные при использовании данных двух платформ, характеризовались низкой сходимостью, в дополнение ко всему результаты выдавались в разных единицах. В качестве одной из возможных причин низкой сходимости результатов можно предположить биоразнообразие изоформ АМГ.
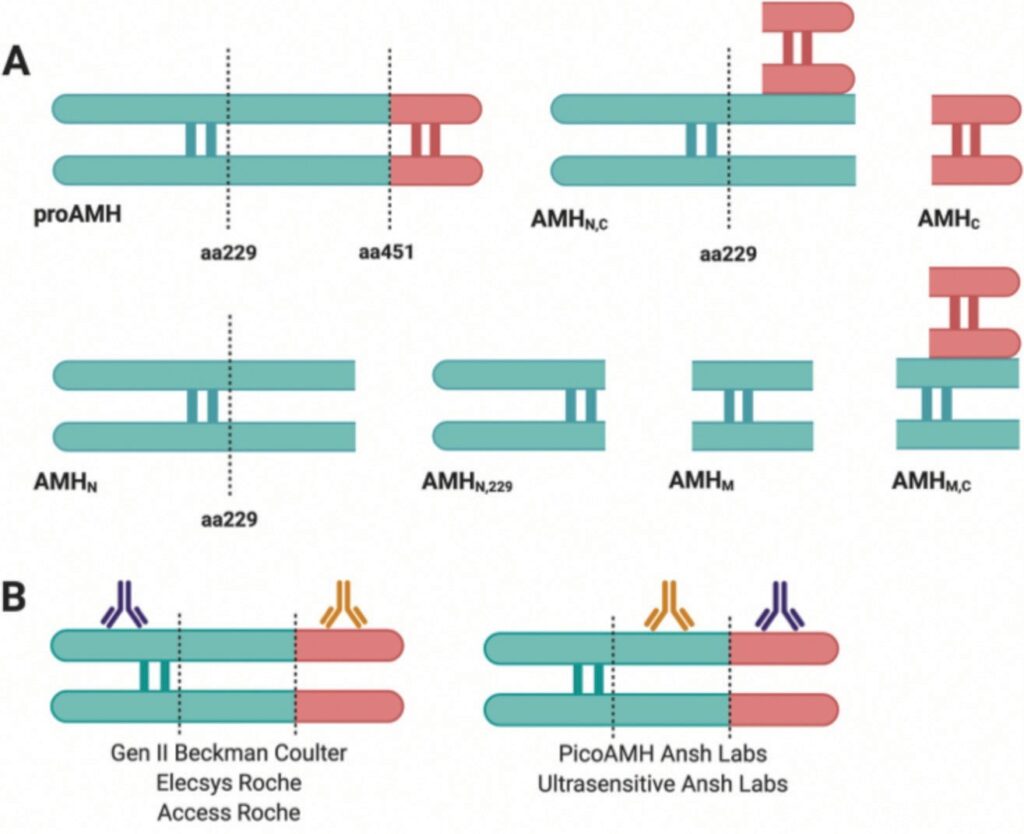
АМГ продуцируется в виде гомодимера с молекулярной массой 140 кДа, который состоит из 560 аминокислотных остатков. В процессе созревания пробелок АМГ претерпевает расщепление связи по аминокислотному остатку в положении 451 с образованием N-концевого профрагмента (AMHN), представлявшего собой димер с молекулярной массой 110 кДа, и С-концевой фрагмент с молекулярной массой 25 кДа, который формирует с профрагментом AMHN стабильный комплекс (AMHN,C).
Рис. 15. Сравнение прогностической ценности показателей концентрации АМГ в сыворотке крови и количества антральных фолликулов для прогнозирования ответа яичников в рамках стимуляции препаратами агонистов ГнРГ (слева) и антагонистов ГнРГ (справа)

Расщепление по аминокислотному остатку в положении 229 способствует формированию еще трех изоформ АМГ (рис. 16).
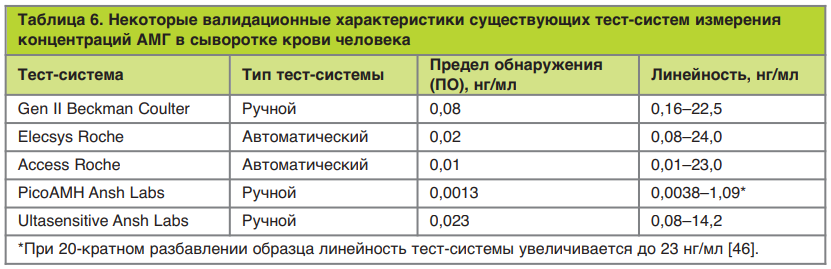
Обозначенная выше проблема в низкой сходимости результатов была решена разработкой новой тест-системы Gen II (Beckman Coulter), которая включила лучшие аспекты предыдущих двух систем. Тем не менее результаты нескольких исследований показали различия в сходимости как внутри анализа, так и между анализами, а также выявили проблемы со стабильностью и хранением образцов, связанные с особенностями системы Gen II [47]. Разработка новой автоматизированной платформы измерения концентрации АМГ в сыворотке крови, которая характеризуется более высокой точностью (в 4 раза), большей скоростью анализа (18 мин против 6 ч) и более высокой чувствительностью, значительно повысила точность количественного определения АМГ в клинической практике (табл. 6).
В настоящее время часто используются ручные тест-системы: модифицированный анализ Gen II (Beckman Coulter) и сверхчувствительный иммуноферментный анализ AMГ (ELISA) и анализ picoAMH (оба разработаны фирмой-производителем Ansh Labs), в которых используются антитела, отличные от анализа Gen II AMH набора. Кроме того, в настоящее время доступны два автоматизированных анализа AMГ: Access AMH (Beckman Coulter) и Elecsys AMH (Roche). Эти автоматизированные анализы используют тот же набор антител, что и тест-система Gen II (см. рис. 16), тем не менее, прямое сравнение значений АМГ, полученных с помощью этих наборов, все еще проблематично. Различия в значениях можно объяснить использованием разных пар антител (для ручных анализов), что может привести к обнаружению разных изоформ АМГ. Также могут иметь значение нестабильность образца или матричный эффект, который влияет на межлабораторную воспроизводимость результатов. Разработка автоматизированных тест-систем повысила точность, воспроизводимость и скорость измерений и, следовательно, превосходит ручные анализы.
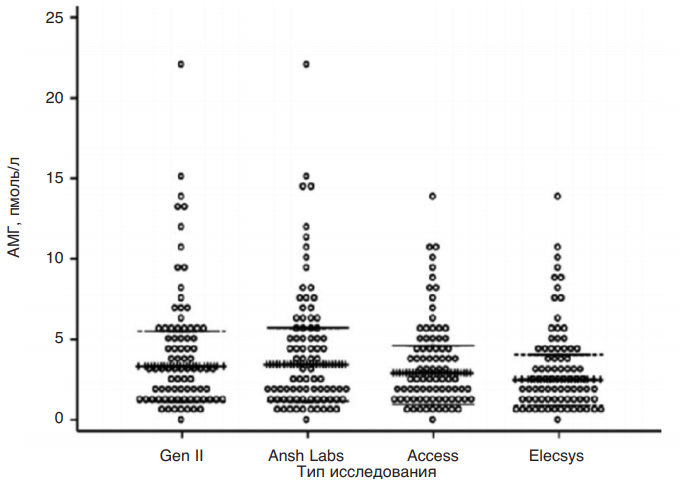
Было проведено сравнение концентраций АМГ у пациенток перед вступлением в программу овариальной стимуляции в процедурах ЭКО/ИКСИ, которые получали при использовании всех четырех тест-систем (рис. 17). Выяснилось, что у одних и тех же пациенток концентрация АМГ при измерении ручными тест-системами Gen II (Beckman Coulter) и сверхчувствительным иммуноферментным анализом AMH ELISA (Ansh Labs) оказалась выше, чем при измерении автоматическими системами, причем наиболее низкий уровень этого гормона оказался при измерении системой AMH Elecsys Plus компании Roche. Также были проведены исследования, которые показали большую прогностическую
Рис. 16. Изоформы АМГ (А, вверху); эпитопы связывания с антителами в иммунологических методах измерения концентрации АМГ, реализованные в наборах Gen II (Beckman Coulter), Elecsys (Roche), Access (Roche), PicoAMH (Ansh Labs), Ultasensitive (Ansh Labs) (В, внизу). Пояснения представлены в тексте [46]
ценность в предсказании числа полученных ооцитов при использовании автоматических систем по сравнению с ручными на основе иммуноферментного анализа, особенно у пациенток со сниженным овариальным резервом.
В исследовании по оценке взаимозаменяемости двух методов определения концентрации АМГ при индивидуальном подборе дозировок ФСГ в циклах ЭКО сравнивали две автоматизированные тест-системы: AMH Access (Beckman Coulter) и AMH Elecsys (Roche). Полученные значения концентраций АМГ использовали для расчета начальной дозы ФСГ, и на основании сравнения определяли долю пациентов, которым назначили бы другую дозировку гонадотропина вследствие расхождения значений АМГ, полученных с помощью разных методов определения. При использовании метода определения AMH Access систематически получали более высокие значения по сравнению с методом определения AMH Elecsys. При использовании метода определения Access AMH вместо AMH Elecsys различие в начальной дозе фоллитропина альфа составило более 15% у 2 из 113 пациенток.
Рис. 17. Концентрации АМГ, измеренные с использованием четырех тест-систем:
Gen II (Beckman Coulter), AMH ELISA (Ansh Labs), AMH Access (Beckman Coulter) и AMH Elecsys Plus (Roche)
При использовании метода определения Access AMH различие в начальной дозе фоллитропина дельта составило более 15% у 21 из 113 пациенток. Что касается женщин с высоким овариальным резервом, то при использовании метода определения Access AMH вместо AMH Elecsys только 4 из 51 получили бы дозу фоллитропина дельта, которая отличалась бы более чем на 15%. Таким образом, можно сделать вывод, что значения, полученные с использованием двух наиболее распространенных систем автоматизированного анализа AMH Elecsys и Access AMH, немного различаются и, по-видимому, мало влияют на расчет дозы фоллитропина, используемой для стимуляции яичников. Клиническим значением данного факта является возможность взаимозаменяемости тест-систем для измерения сывороточной концентрации АМГ, полученных с помощью обоих методов определения.
Исследования применения фоллитропина дельта для контролируемой стимуляции яичников в Европе и мире
В исследованиях в рамках первой фазы клинических испытаний проводили сравнение концентраций ФСГ и эстрадиола, а также оценивали количество растущих фолликулов на фоне ежедневных приемов препаратов фоллитропина альфа и фоллитропина дельта в дозировке 225 МЕ/сут в течение 7 дней. Стоит отметить, что во время первой фазы клинических исследований биоактивность фоллитропина дельта оценивалась с помощью теста Стилмана–Поли, который впоследствии, как было уже сказано, показал свою иррелевантность. По результатам исследований отмечено, что применение фоллитропина дельта способствовало более высоким сывороточным концентрациям ФСГ и эстрадиола, а также большему количеству растущих фолликулов (рис. 18).
Полученные данные позволили сделать вывод о более высокой биоактивности фоллитропина дельта в организме человека по сравнению с фоллитропином альфа при дозировании препарата в МЕ, что предопределило отказ от теста Стилмана–Поли для оценки активности субстанции и решение проводить расчет дозировки (в мкг).
Рис. 18. Оценка сывороточных концентраций ФСГ и эстрадиола, а также количества растущих фолликулов на фоне ежедневного приема фоллитропинов альфа и дельта в дозировке 225 мЕд/сут в течение 7 дней

Для расчета оптимальной дозировки фоллитропина дельта в качестве потенциальных маркеров, по которым возможно было бы спрогнозировать ответ яичников при стимуляции, рассматривали концентрации АМГ, базальный уровень эндогенного ФСГ, концентрацию ингибина В, а также массу тела пациентки, количество антральных фолликулов и возраст пациенток. Согласно полученным результатам, показано, что наиболее удачными маркерами, которые могут более точно предсказать ответ яичников на стимуляцию фоллитропином дельта, является сывороточная концентрация АМГ, а также масса тела пациентки, а базальный уровень эндогенного ФСГ, уровень ингибина В, количество антральных фолликулов и возраст пациенток оказались менее значимыми показателями (табл. 7).
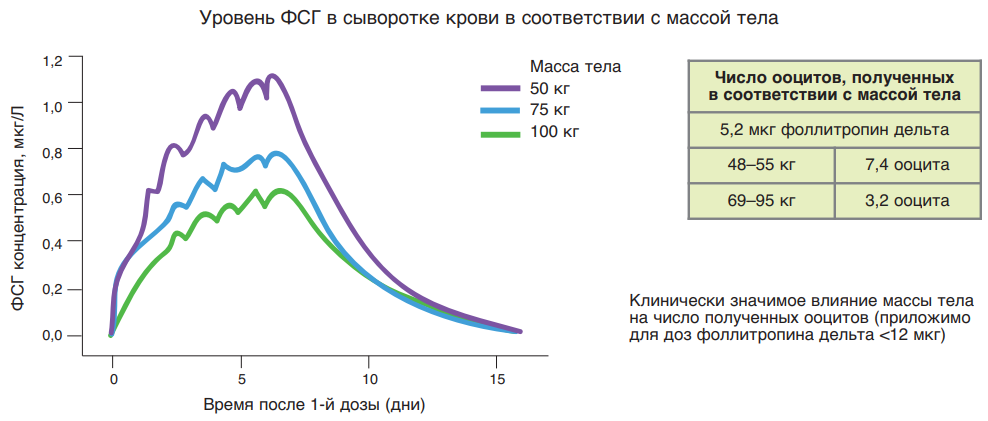
В частности, в одном из исследований фармакокинетических свойств фоллитропина дельта показано, что при введении препарата в одинаковой дозировке 5,2 мкг пациенткам с массой тела от 48 до 55 кг позволило получить в среднем 7,4 ооцита, в то время как при введении препарата в такой же дозировке у пациенток с массой тела от 69 до 95 кг позволило получить в среднем 3,2 ооцита. Полученные данные позволяют сделать вывод о важности учитывать массу тела пациентки при расчете дозировки фоллитропина дельта (рис. 19).
Рис. 19. Изменение сывороточной концентрации ФСГ и число ооцитов, полученных при стимуляции фоллитропином дельта у пациенток с массой тела 48–55 и 69–95 кг соответственно.
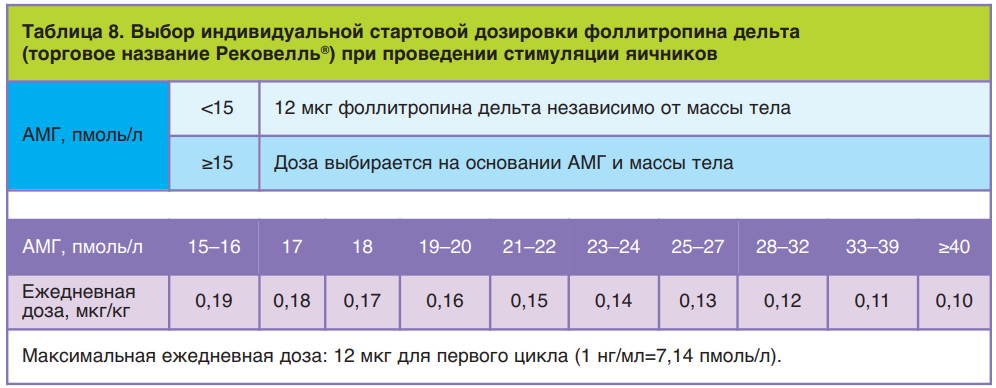
Во второй фазе исследований разработали алгоритм применения фоллитропина дельта, согласно которому у пациенток с концентрацией АМГ менее 15 пмоль/л (2,1 нг/мл) препарат применяется в ежедневной дозировке 12 мкг подкожно; у пациенток с концентрацией АМГ от 15 пмоль/л ежедневная дозировка высчитывается на основании АМГ и массы тела пациентки индивидуально, но не более 12 мкг (табл. 8). Ниже приведены различные случаи расчета дозировки Рековелль® у пациенток разного клинического профиля.
ESTHER-1
Для определения клинической эффективности фоллитропина дельта по сравнению с фоллитропином альфа было проведено рандомизированное контролируемое слепое многонациональное исследование в параллельных группах, получившее название ESTHER-1 (от англ. Evidence-based Stimula- tion Trial with Human Recombinant Follicle-Stimulating Hormone in Europe and Rest of World-1). Данное исследование проводилось в клиниках лечения бесплодия одиннадцати стран: Бельгии, Бразилии, Канады, Чехии, Дании, Франции, Италии, Польши, Российской Федерации, Испании и Великобритании.
Общее число пациенток, включенных в это исследование, составило 1329 человек. Критериями включения были: возраст пациенток, индекс массы тела, регулярность и продолжительность менструальных циклов, наличие обоих яичников, сывороточная концентрация ФСГ, причина бесплодия и история его преодоления. Так, согласно требованиям, в исследовании приняли участие пациентки в возрасте от 18 до 40 лет с индексом массы тела от 17,5 до 32,0 кг/м2 с постоянными менструальными циклами продолжительностью от 24 до 35 дней, которые впервые обращались за помощью методами вспомогательных репродуктивных технологий, при этом причиной бесплодия был один из следующих диагнозов: бесплодие неясного генеза, трубный фактор бесплодия, эндометриоз I/II стадии и мужское бесплодие, а концентрация эндогенного ФСГ в сыворотке крови в ранней фолликулярной фазе составляла 1–15 МЕ/л. Пациентки с эндометриозом III–IV стадии, привычным невынашиванием беременности и использованием гормональных препаратов (за исключением гормонов щитовидной железы) во время последнего менструального цикла перед предполагаемой стимуляцией в исследование не включались. В группу приема Рековелль® вошли 665 пациенток, для каждой из которой осуществлялся индивидуальный расчет дозировки в зависимости от концентрации АМГ и массы тела по указанному выше алгоритму. В контрольной группе стимуляция суперовуляции проводилась препаратом фоллитропина альфа с торговым названием Гонал-Ф® по следующей схеме: в течение первых 5 дней стимуляции дозировка фоллитропина альфа была фиксированной у всех пациенток и составила 150 МЕ/сут (11 мкг/сут), с 6-го дня стимуляции дозировку при необходимости повышали или понижали в зависимости от ответа яичников при максимальной дозировке 450 МЕ/сут. Во всех группах исследования стимуляция препаратами р-чФСГ начиналась на 2–3-й день менструального цикла, а препараты антагониста ГнРГ (торговое название Цетротид®) назначались с 6-го дня овариальной стимуляции в дозировке 0,25 мг подкожно ежедневно. Для определения сывороточной концентрации АМГ при расчете индивидуальной дозировки Рековелль® применялась автоматическая система AMH Elecsys Plus компании-производителя Roche в день начала стимуляции.
Триггер назначался при наличии трех или более фолликулов с диаметром от 17 мм. Женщинам с количеством фолликулов более 25 с диаметром от 12 мм в качестве триггера вводили рекомбинантный ХГЧ (хориогонадотропин альфа, торговое название Овитрель®) в дозировке 250 мг подкожно. Женщинам с количеством фолликулов в диапазоне 25–35 и диаметром фолликулов от 12 мм вводили препарат агониста ГнРГ (трипторелин ацетат, копания Ferring Pharmaceuticals) в дозировке 0,2 мг подкожно. Пункцию фолликулов проводили через 36±2 ч после введения триггера, или цикл исключали из исследования в случае пациенток с ожидаемым количеством фолликулов более 35 (при диаметре от 12 мм). В случае плохого ответа яичников на стимуляцию при опасениях невозможности получения трех или более фолликулов с диаметром ≥7 мм к 20-му дню стимуляции цикл отменяли. Оплодотворение ооцитов проводили методами ЭКО или посредством введения сперматозоида в яйцеклетку (ИКСИ, от англ. ICSI – IntraCytoplasmic Sperm Injection) спермой партнера или донора. При использовании в качестве триггера агониста ГнРГ все полученные эмбрионы подвергались криоконсервации; у пациенток, у которых применяли р-чХГЧ в качестве триггера, на пятый день переносили одну бластоцисту любого качества, если пациентка была моложе 37 лет, и при наличии бластоцисты степени качества 3BB или выше в группе более старших пациенток. Оставшиеся бластоцисты криоконсервировали. Вагинальные таблетки прогестерона (торговые названия Лютинус®/Эндометрин®) назначали в дозировке 100 мг 3 раза в сутки со дня пункции в течение последующих 13–15 дней. Поддержку отменяли при подтверждении беременности на основании значений концентрации сывороточного ХГЧ. Ультразвуковое исследование выполняли через 5–6 нед и 10–11 нед после переноса бластоцисты для подтверждения клинической и прогрессирующей беременности соответственно. Наблюдение продолжали до родов и следующие 4 нед после них. Нежелательные явления регистрировали с момента подписания информированного согласия до завершения исследования. Конечными первичными точками исследования приняты следующие:
частота прогрессирующей беременности, которая устанавливалась на основании наличия по крайней мере одного жизнеспособного плода в полости матки через 10–11 нед после переноса, и частота имплантации эмбриона, определяемая как количество жизнеспособных плодов через 10–11 нед после переноса, деленное на количество перенесенных бластоцист. Вторичные конечные точки исследования включали исходы беременности и, в частности, частоту живорождений (определяемую как рождение по меньшей мере одного живого ребенка), целевой ответ яичников (8–14 ооцитов) и нецелевые ответы яичников (<4, ≥15 или ≥20 ооцитов), эмбриологические показатели, безопасность стимуляции и нежелательные явления. Среди эмбриологических показателей оценивали число оплодотворенных ооцитов, частоту оплодотворения, число эмбрионов на 3 и 5-й дни развития, общее и хорошего качества число эмбрионов, число криоконсервированных бластоцист и процент пациенток с криоконсервацией эмбрионов. При изучении влияния стимуляции на безопасность принимали в расчет частоту применения превентивных мер для предотвращения развития синдрома гиперстимуляции яичников (СГЯ) и частоту возникновения СГЯ; при оценке нежелательных явлений оценивали частоту госпитализации при возникновении СГЯ и число дней госпитализации. Конечные точки безопасности включали долю женщин с развитием раннего и позднего СГЯ (включая СГЯ средней/тяжелой степени, классифицированные с использованием системы Голана) и/или про- филактическими вмешательствами в отношении раннего СГЯ (в том числе отмена цикла из-за чрезмерного ответа яичников, триггер с использованием агониста ГнРГ или применение агониста дофамина у женщин с более 20 фолликулами диаметром от 12 мм). В табл. 9 представлены данные по первичным данным и исходам беременности.
Полученные результаты свидетельствуют о сопоставимой эффективности индивидуального расчета дозировки фоллитропина дельта по сравнению со стандартной схемой стимуляции фоллитропином альфа: в обеих группах не выявлено значимых различий в частоте продолжающейся беременности и имплантации, а также в частоте живорождений, клинической беременности, имплантации и многоплодной беременности.
Анализ вторичных конечных точек, эмбриологических показателей и показателей безопасности выявил, что существуют значительные различия в исследованных группах (табл. 10).
Целевой ответ яичников при количестве полученных ооцитов составляет от 8 до 14, статистически чаще зафиксирован в группе с индивидуальным расчетом дозировки фоллитропина дельта по сравнению со стандартным применением фоллитропина альфа (43,3 и 38,4% при р=0,019 соответственно). Также в группе приема фоллитропина дельта по сравнению с группой фоллитропина альфа реже наблюдалась необходимость в замене триггера на агонист ГнРГ (1,5 и 3,5% при р=0,019 соответственно) при ответе яичников в группах с числом ооцитов менее 4 или более 15 и более 4 или менее 20 (26,6 и 31,3% при р=0,001 соответственно, и 14,5 и 18,4% при р=0,002 соответственно), а также меньшая частота развития СГЯ (23,3 и 4,5% при р=0,005 соответственно). На рис. 19 показано, что увеличение числа полученных ооцитов с увеличением уровня АМГ в крови пациенток при применении индивидуального протокола подбора дозировки фоллитропина дельта происходит более плавно, чем при использовании стандартного протокола фоллитропина альфа, при этом число полученных бластоцист хорошего качества не увеличивается.
Авторы исследования сделали выводы о сопоставимой эффективности при анализе первичных конечных точек в виде частоты продолжающейся беременности и продолжающейся имплантации, в то время как при индивидуальном расчете дозировки фоллитропина дельта без каких-либо коррекций дозы во время стимуляции большее количество женщин достигло предварительно установленного целевого ответа яичников (8–14 полученных ооцитов) с меньшим количеством зарегистрированных клинически значимых случаев недостаточного/избыточного ответа яичников и более низкой потребности в проведении мер профилактики СГЯ.
Дизайн исследования включал комбинированную конечную точку в виде развития раннего СГЯ и/или проведения вмешательств для профилактики раннего СГЯ (в соответствии с критериями,
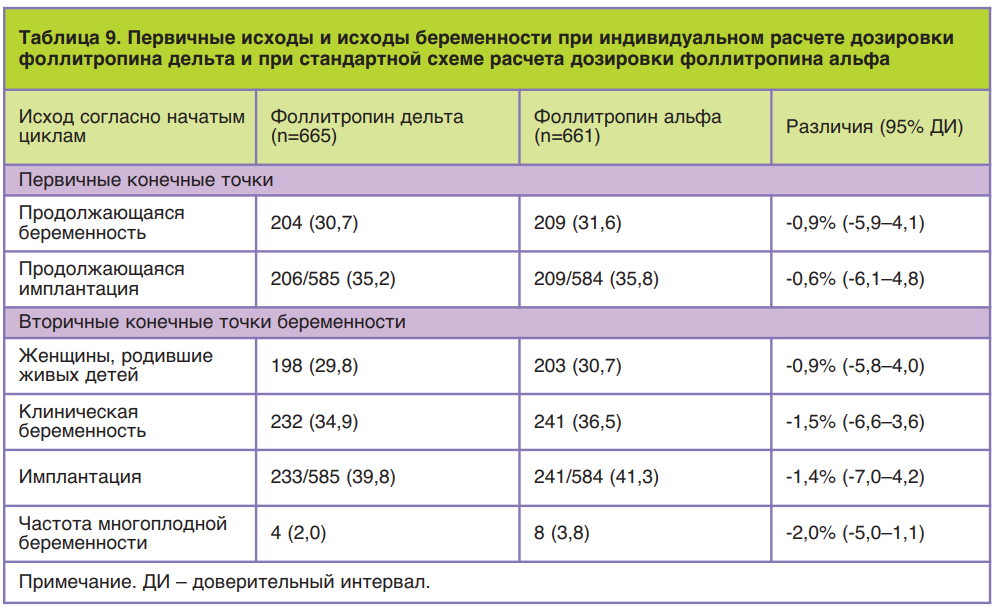
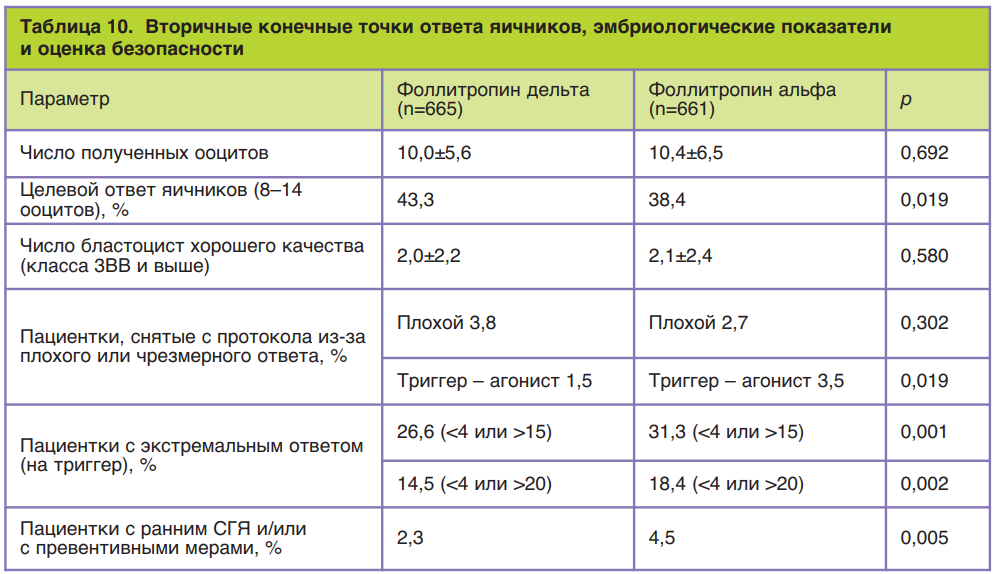
установленными в протоколе), поскольку регистрация только случаев СГЯ могла привести к недооценке гиперстимуляции, вызванной гонадотропинами. Крупномасштабные популяционные данные при использовании стандартной стимуляции яичников фоллитропином альфа продемонстрировали положительную линейную зависимость между получением ооцитов и частотой живорождения у пациенток с числом 15 ооцитов и менее. Стоит отметить, что при получении более 15 ооцитов увеличения частоты живорождения не наблюдалось, но при этом экспоненциально повышается риск развития СГЯ, в связи с чем необходимы рекомендации по применению менее агрессивной стимуляции при сохранении адекватного выхода ооцитов. Несмотря на то, что целевое значение количества ооцитов, получаемых при пункции (8–14 ооцитов), может потенциально восприниматься как низкое, установка на более высокий целевой показатель будет сопровождаться повышением риска развития СГЯ, поскольку стандартное отклонение выше наблюдаемого среднего выхода ооцитов составляло более 15 ооцитов в обеих группах лечения. Кроме того, получение 15 ооцитов и более сопровождается увеличением чувства дискомфорта в животе, как это было отмечено на основании оценок по визуальным аналоговым шкалам, заполненным пациентками. Коэффициенты живорождения в результате свежих циклов с переносом бластоцист были сопоставимыми у пациенток в обеих группах лечения и ввиду того, что для криоконсервации было доступно одинаковое количество бластоцист хорошего качества; любое численное различие в количестве ооцитов, полученных во время пункции, вряд ли будет считаться преимуществом и может привести к повышению риска развития СГЯ. Поскольку увеличения частоты живорождения не происходит, но при этом экспоненциально повышается риск развития СГЯ, существуют рекомендации по применению менее агрессивной стимуляции при сохранении адекватного выхода ооцитов. Строгие критерии стимуляции в цикле для проведения вмешательств по профилактике СГЯ в сочетании с эффективностью этих профилактических вмешательств могут уменьшить различия между группами в отношении как частоты развития, так и тяжести СГЯ. В настоящем исследовании, в котором использовались широкие критерии включения, было спрогнозировано, что у 42% группы индивидуализированного режима дозирования количество ооцитов на пункции в среднем составит 8–14 ооцитов, и этот прогноз был подтвержден: 43% достигли прогнозируемого целевого выхода.
В группе с использованием фоллитропина дельта доза была фиксированной на протяжении всей стимуляции, в то время как для фоллитропина альфа изменение дозы могло быть после первых 5 дней стимуляции. Несмотря на то, что исходная стартовая доза фоллитропина альфа 150 МЕ/сут может показаться недостаточной, особенно для женщин более позднего возраста, выбранная доза
Рис. 19. Количество полученных ооцитов (две верхние кривые) и количество бластоцист хорошего качества для переноса (две нижние кривые) в зависимости от концентрации АМГ в сыворотке крови пациентов в двух группах лечения: группа стимуляции фоллитропином альфа (оранжевый) и фоллитропином дельта (фиолетовый)
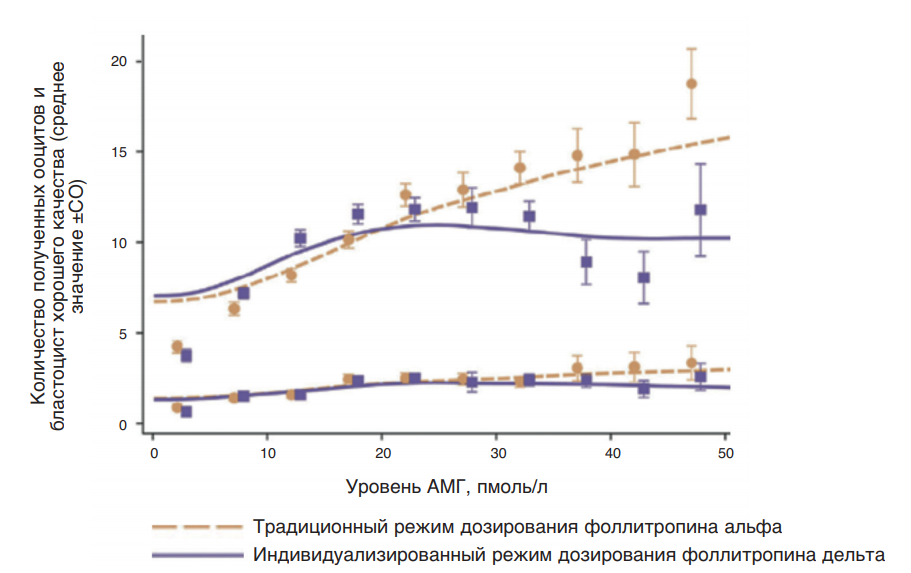
соответствует инструкции по применению препарата. Стоит отметить, что при дозировке фоллитропина альфа 150 МЕ/сут также наблюдалось развитие нежелательных эффектов, и в случае более высокой дозы можно предположить, что их могло быть еще больше. Ввиду того, что примерно для трети пациенток в группе фоллитропина альфа по истечении пятого дня стимуляции лечащий врач изменял исходную дозировку препарата, преимущественно увеличивая дозировку, можно сделать предположение о существовании положительного эффекта высоких доз препаратов ФСГ на исход стимуляции. Однако результаты метаанализа 10 исследований, которое включило результаты 1952 циклов ЭКО, не выявили значительного положительного влияния концентраций ФСГ выше 200 МЕ/сут, в то время как метаанализ, включивший 658 519 циклов ЭКО, показал снижение частоты живорождений при дозах ФСГ выше 300 МЕ/сут, независимо от возраста женщины, количества полученных ооцитов или основного диагноз.
Таким образом, исследование ESTHER-1 показало, что индивидуальный расчет дозировки фоллитропина дельта без каких-либо коррекций дозы по запросу, как это было в контрольной группе фоллитропина альфа (большинство из которых составляли запросы на увеличение дозы), обеспечил достижение целевого ответа у большего количества женщин. Индивидуальный расчет дозировки фоллитропина дельта может иметь преимущества для пациенток с точки зрения более простых инструкций по приему, а также потенциально снижать количество посещений врача для мониторинга.
ESTHER-2
Исследование ESTHER-1 было продолжено в рамках третьей фазы клинических исследований препарата, которая получила название ESTHER-2. На рис. 20 представлен дизайн этого рандомизированного контролируемого исследования.
Критерии включения в исследование ESTHER-2: участие пациентки в исследовании ESTHER-1, наличие информации об уровне антител к ФСГ до начала исследований и после первого цикла стимуляции; не наступление беременности в первом цикле стимуляции суперовуляции; проведение пункции яичников в первом цикле или снятие с протокола по причине плохого или избыточного ответа. Критерии исключения: наличие сторонних стимуляций после первого цикла стимуляции суперовуляции, один или более фолликулов диаметром более 10 мм на первый предполагаемый день стимуляции, тяжелая степень СГЯ в первом цикле, изменение общей медицинской истории после первого цикла. В табл. 11 представлено распределение пациенток в исследованиях ESTHER-1 и ESTHER-2.
Рис. 20. Дизайн исследования ESTHER-2
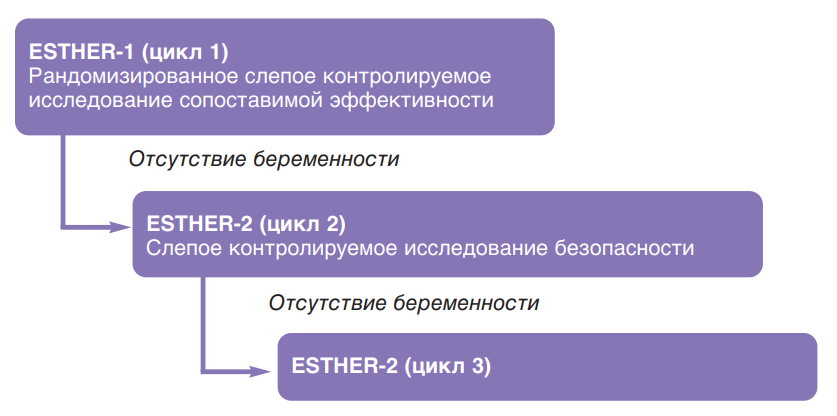
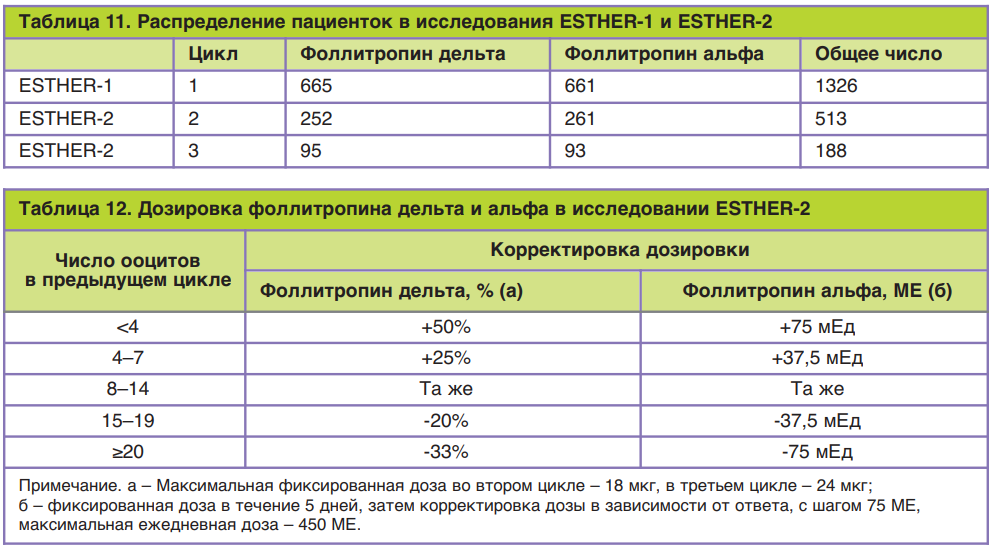
Рис. 21. Частота умеренного/тяжелого СГЯ и/или профилактических вмешательств в зависимости от концентрации АМГ при скрининге в первом цикле. Квартили АМГ. Q1: АМГ <8,99 пмоль/л,
Q2: АМГ от 8,99 до <16,14 пмоль/л, Q3: АМГ от 16,14 до <25,35 пмоль/л, Q4: АМГ ≥25,35 пмоль/л. NS – не значимо, ОШ – отношение шансов.
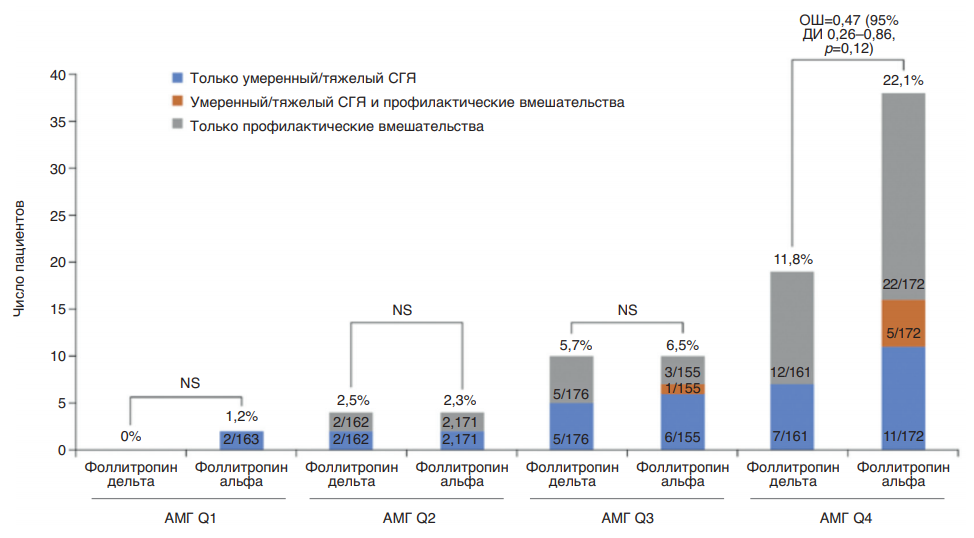
В отличие от предыдущего исследования в исследовании ESTHER-2 проводилась коррекция доз фоллитропинов дельта и альфа, в зависимости от предыдущего ответа на стимуляцию (табл. 12). Показано, что тактика индивидуального расчета дозировки фоллитропина дельта эффективна с целью профилактики развития СГЯ (рис. 21).
Различия в снижении развития СГЯ достигли статистической значимости в группе с самым высоким уровнем АМГ ≥25,35 пмоль/л (≥3,55 нг/мл), ОШ=0,47 (95% ДИ 0,26–0,86 при р=0,012), причем в группе приема фоллитропина дельта не наблюдалось случаев умеренного/тяжелого СГЯ при использовании следующих профилактических вмешательств: (I) отмена цикла при количестве фолликулов более 35 с диаметром от 12 мм, (II) замена триггера овуляции на агонист ГнРГ с криоконсервацией всех полученных эмбрионов, (III) отмена цикла, если 25–35 фолликулов были ≥12 мм, и (IV) введение агониста дофамина, если в конце стимуляции на УЗИ наблюдались ≥20 фолликулов с диаметром от 12 мм. Более того, частота умеренного/выраженного СГЯ была стабильной во всех трех циклах контролируемой овариальной стимуляции (КОС) при использовании фоллитропина дельта, тогда как в группе фоллитропина альфа имелась тенденция к повышению этой частоты развития СГЯ (рис. 22). В недавних исследованиях в рамках ESTHER-1 сравнивали риск развития СГЯ у пациенток с высокими концентрациями АМГ (более 35 пмоль/л) при приеме фоллитропинов альфа (78 пациенток) и дельта (75 пациенток).
Рис. 22. Частота умеренного/выраженного СГЯ в трех циклах КОС в рамках исследований ESTHER-1 и ESTHER-2

Показано, что СГЯ чаще развивается у пациенток с высокими концентрациями АМГ при приеме фоллитропина альфа, чем при приеме фоллитропина дельта: 26,7 и 7,7% соответственно.
Кумулятивная частота умеренного/тяжелого СГЯ и профилактических вмешательствах в трех циклах КОС представлена в табл. 13. Расчет индивидуальной дозы фоллитропина дельта по сравнению со стандартным протоколом фоллитропина альфа показал статистически значимые преимущества: развитие СГЯ средней/тяжелой степени 0,50 (95% ДИ 0,26–0,97 при р=0,036), необходимость профилактических вмешательств 0,56 (95% ДИ 0,31–0,99 при р=0,044), СГЯ средней/тяжелой степени и/или профилактические вмешательства 0,59 (95% ДИ 0,38–0,92 при р=0,018).
Доза препаратов во втором и третьем циклах определялась на основании анализа ответа яичников в предыдущем цикле (рис. 23). Доля пациенток, которые сохранили ту же дозировку/начальную
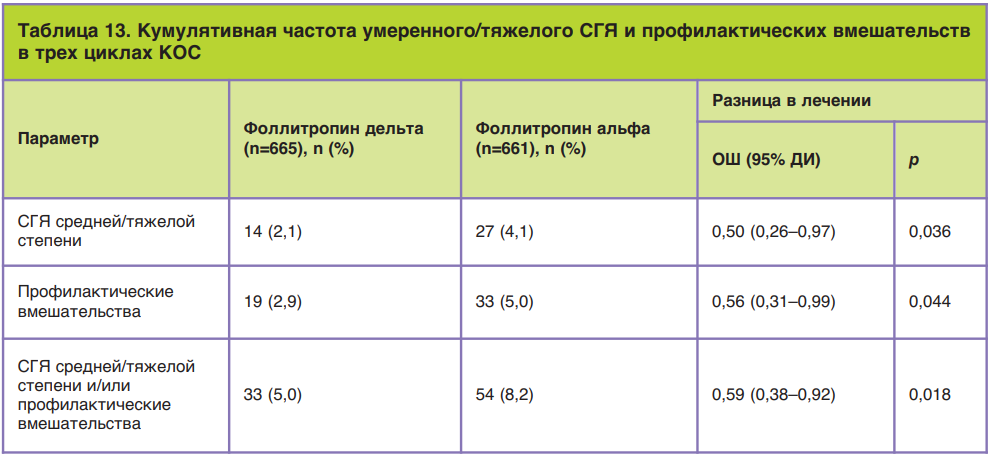
Рис. 23. Дозировка фоллитропинов дельта и альфа во втором и третьем циклах стимуляции в исследовании ESTHER-2
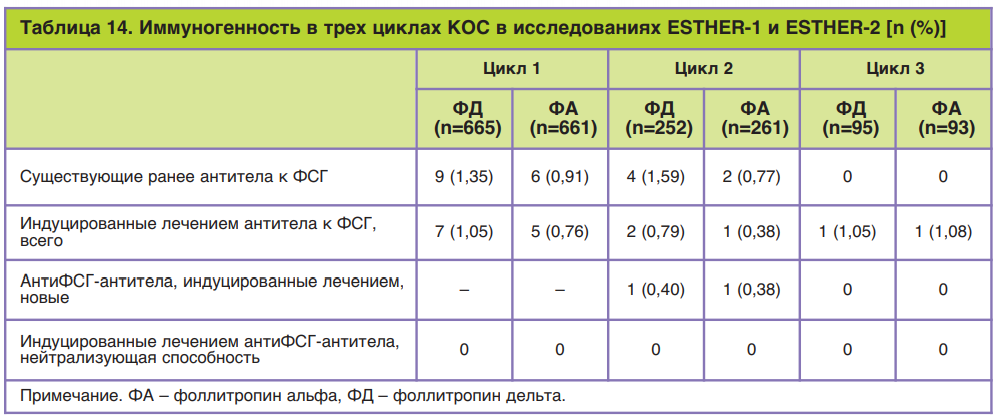
дозировку в повторных циклах, составила 40,9% против 33,3% в группах фоллитропина дельта и фоллитропина альфа соответственно во втором цикле и 43,2% против 41,9% соответственно в третьем цикле.
Безопасность – иммуногенность
Иммуногенность препаратов фоллитропина дельта и альфа была изучена на протяжении трех циклов стимуляции (табл. 14). Антитела к ФСГ измеряли до и после введения препарата пациенткам, которым проводилось до трех повторных циклов лечения препаратом Рековелль®. Частота появления антител к ФСГ после лечения препаратом Рековелль® составила 1,1% в 1-м цикле, 0,8% во 2-м цикле и 1,1% в третьем цикле. В третьем цикле показатели были аналогичны частоте ранее существовавших антител против ФСГ до воздействия Рековелль® в цикле 1, которая составляла 1,4%, и сопоставима с частотой появления антител против ФСГ после лечения фоллитропином альфа. У всех пациентов с антителами к ФСГ титры были неопределяемыми или очень низкими и не имели нейтрализующей способности. Повторное лечение препаратом Рековелль® пациентов с ранее существовавшими или вызванными лечением антителами к ФСГ не увеличивало титр антител, не бы-
Рис. 24. Кумулятивная частота продолжающейся беременности, родов и неонатальная выживаемость в течение 4 нед после родов в трех циклах стимуляции
ло связано со снижением ответа яичников и не вызывало побочных эффектов, связанных с иммунитетом. Таким образом, объединенные данные всех трех циклов показывают, что частота возникновения анти-ФСГ антител при повторной стимуляции препаратом фоллитропин дельта низкая и сопоставима с показателями ранее существовавших антител. У женщин с индуцированными лечением антителами к ФСГ после лечения фоллитропином дельта наблюдался временный иммунный ответ с низкими титрами антител без способности нейтрализовать ФСГ и без зафиксированного клинического эффекта. Опыт клинических испытаний препарата Рековелль® в рамках длинного протокола с агонистами ГнРГ отсутствует.
На рис. 24 показана кумулятивная частота продолжающейся беременности, родов и неонатальная выживаемость в течение 4 нед после родов в трех циклах стимуляции. Различий в группах с использованием индивидуальной рассчитанной дозировки фоллитропина дельта и стандартного назначения фоллитропина альфа не выявлено.
Текущие исследования по препарату Рековелль (2018–2021 гг.)
MARCS
В результате анализа 1591 цикла ЭКО/ИКСИ в рамках испытаний фазы II и III установлено, что ежедневная дозировка фоллитропина дельта 10 мкг соответствует ежедневной дозировке 150 МЕ фоллитропина альфа. В последнее время появился интерес к использованию комбинированных схем с применением фоллитропина дельта с мочевым высокоочищенным менопаузальным гонадотропином (ЧМГ-ВО). В частности, было предложено комбинировать фоллитропин дельта (Реко- велль®) с мочевым высокоочищенным менопаузальным гонадотропином (Менопур®), результаты клинического применения такой комбинации недавно были опубликованы в рамках исследования Menopur and Rekovelle Combined Study (MARCS). Критерии включения и исключения в исследовании были схожи с таковыми в исследовании ESTHER-1. Конечными точками данного исследования были число бластоцист хорошего качества и частота СГЯ. Использовались следующие правила при комбинации препаратов: если начальная расчетная дозировка препарата Рековелль® была менее 12 мг/сут, то назначалось дополнительное ежедневное введение препарата Менопур® в дозировке
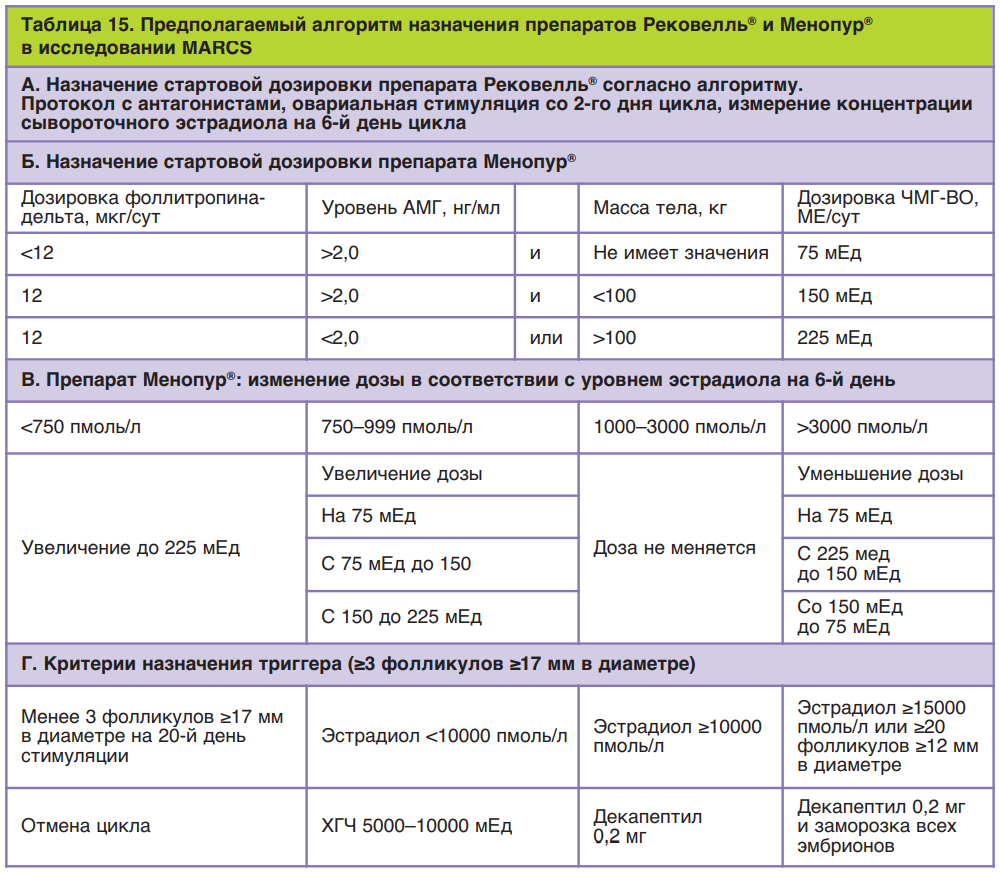
75 МЕ/сут; при дозировке препарата Рековелль® 12 мкг/сут и массе тела пациентки менее 100 кг дозировка препарата Менопур® составляла 150 МЕ/сут, а при массе более 100 кг – 225 МЕ/сут соответственно. Критерии назначения и изменения дозы препарата Менопур®, а также критерии назначения триггера представлены в табл. 15. В качестве контрольной группы были использованы данные из исследования ESTHER-1.
При сравнении результатов двух исследований выяснилось, что у пациенток в исследовании MARCS была выше общая доза препарата Рековелль®, продолжительность стимуляции была длиннее, наблюдалась высокая частота замены триггера, при этом было получено большее число ооцитов и бластоцист. В то же время чаще наблюдалась СГЯ, однако в отличие от исследования ESTHER-1, случаев средней/выраженной СГЯ отмечено не было (табл. 16). Также стоит отметить, что в исследовании MARCS среднее число бластоцист составило 4 бластоцисты хорошего качества во всех возрастных группах, при этом средний возраст и масса тела были больше, а концентрация АМГ ниже, чем в исследовании ESTHER-1. При этом частота отмены цикла из-за плохого ответа на стимуляцию яичников была ниже.
В другом сравнительном ретроспективном анализе показано, что при применении фоллитропина дельта по сравнению с фоллитропинами альфа и бета было получено меньшее количество ооцитов (10,4±6,1 и 12,3±7,7 при р=0,033 соответственно). В то же время частота формирования эмбрионов хорошего качества не различалась, как и частота наступления клинической беременности на 3 и
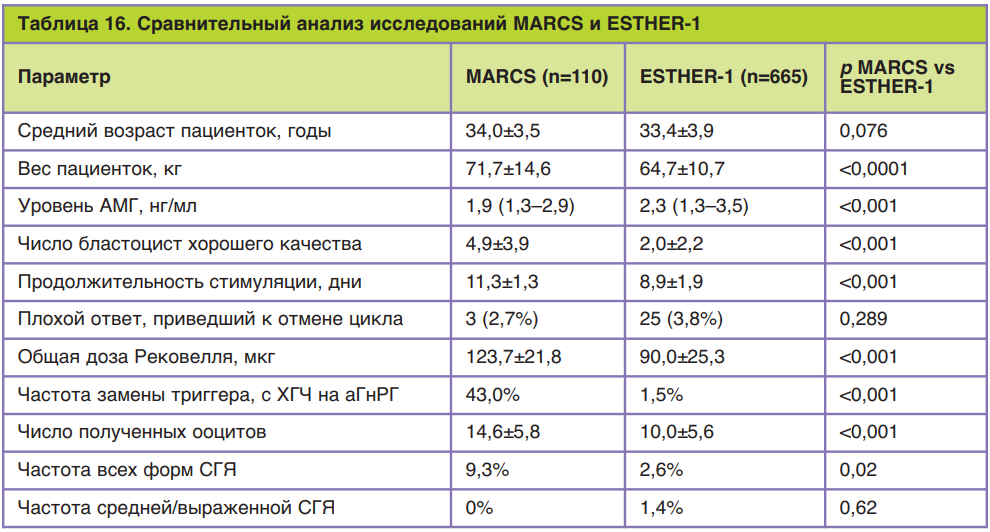
5-й дни переноса: 38,7 и 35,3% и 38,5 и 37,6% соответственно, что говорит о высокой эффективности препарата Рековелль®. Также был опубликован анализ перинатальных исходов беременностей, наступивших после проведения исследований ESTHER-1 и ESTHER-2. В ходе анализа перинатальных исходов беременностей, наступивших после проведения исследований ESTHER-1 и ESTHER-2, произведена оценка данных наблюдения за 444 новорожденными (из них 34 из двоен) в группе фоллитропина дельта и 454 плода (из них 40 из двоен) в группе фоллитропина альфа. Средний срок беременности составил 38,7 нед в обеих группах. Частота пороков развития новорожденных составила в группе фоллитропина дельта 2,5% (11 из 433) и в группе фоллитропина альфа 3,2% (14 из 440). Данные этого исследования говорят об отсутствии нежелательных неонатальных эффектов при лечении препаратом фоллитропин дельта.
STORK
Рандомизированное слепое стратифицированное исследование STORK выполнено для сравнения применения индивидуального расчета дозировки фоллитропина дельта и стандартного приема фоллитропина бета у японских пациенток в программах контролируемой стимуляции яичников ЭКО/ИКСИ.
Основные задачи исследования состояли в оценке эффективности применения фоллитропина дельта в популяции японских женщин и влияния индивидуального подбора дозировки в зависимости от концентрации АМГ и массы тела пациентки, а также в доказательстве сопоставимой эффективности фоллитропина дельта и фоллитропина бета в качестве полученных ооцитов, оценить частоту развития СГЯ и соотношение «польза–риск» в свежих циклах.
Во вторую фазу японского исследования STORK (2017–2020 гг.) вошли 158 пациенток в возрасте от 20 до 39 лет, у которых причина бесплодия заключалась в трубном, мужском факторе, эндометриозе I/II стадии; также в группу пациенток вошли женщины с бесплодием неясного генеза. Критериями исключения служили наличие эндометриоза III/IV стадии, более трех-четырех предшествующих попыток овариальной стимуляции в программах ЭКО/ИКСИ, наличие привычного невынашивания беременности, а также прием гормональных препаратов в предыдущем цикле. Пациентки были разделены на 4 группы перед вступлением в программу ЭКО/ИКСИ. В зависимости от концентрации АМГ пациенток разделили в группы с низким значением АМГ 0,7–2,1 нг/мл и в группу с высоким АМГ при значениях в сыворотке крови 2,1–6,3 нг/мл. Все пациентки получали стандартный протокол
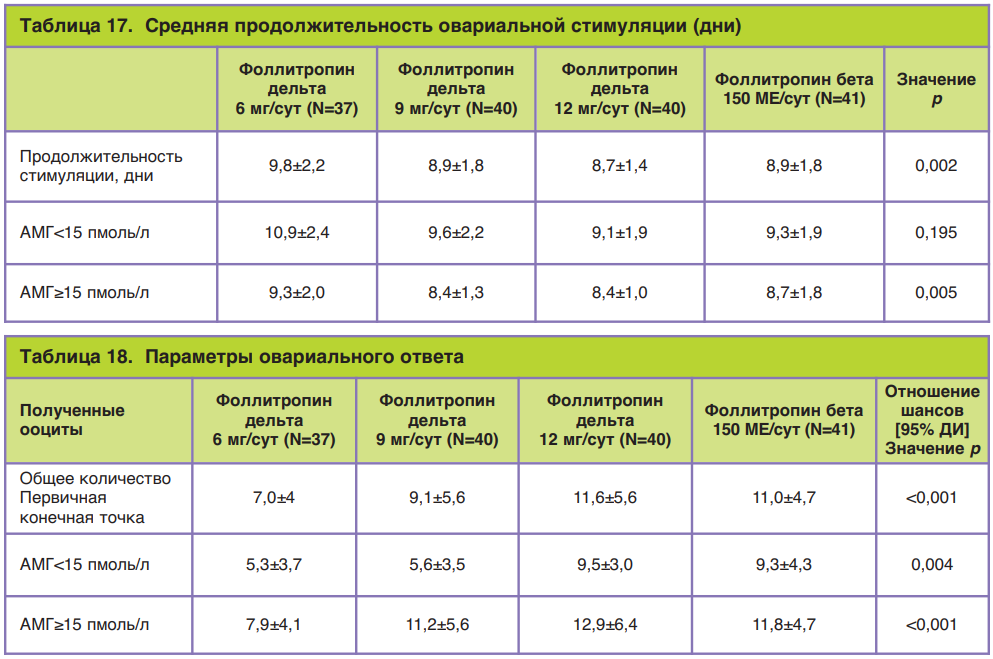
Рис. 25. Частота жизнеспособных беременностей на начатый цикл (данные представлены на группу в целом, без деления по концентрации АМГ)
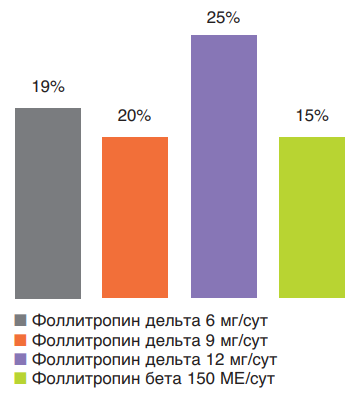
с антагонистами с назначением ганиреликса с 6-го дня стимуляции. Первая группа получала фоллитропин дельта в дозировке 6 мкг/сут, вторая – 9 мкг/сут, третья – 12 мкг/сут и четвертая группа получала фиксированную дозировку 150 МЕ фоллитропина бета в день (контрольная группа). Средняя продолжительность стимуляции в четырех группах составила 9,8, 8,9, 8,7 и 8,9 дня соответственно (табл. 17). Среднее число полученных ооцитов составило 7,0 в группе с дозировкой фоллитропина дельта 6 мкг/сут, 9,1 – в группе дозировки фоллитропина дельта 9 мкг/сут, 11,6 – в группе дозировки фоллитропина дельта 12 мкг/сут и 11,0 – в группе приема фоллитропина бета (табл. 18). После оплодотворения ооцитов культивирование проводилось до 5-го дня, после чего осуществлялся перенос одной бластоцисты. Остальные бластоцисты замораживались. Частота жизнеспособной беременности на начатый цикл составила 19% в группе фоллитропина дельта с дозировкой 6 мкг/сут, 20% – в группе фоллитропина дельта с дозировкой 9 мкг/сут, 25% – в группе фоллитропина дельта с дозировкой 12 мкг/сут и 15% – в группе приема фоллитропина бета (рис. 25). Частота среднего/выраженного раннего СГЯ составила 8% в группе фоллитропина дельта с дозировкой 6 мкг/сут, 8% – в группе фоллитропина дельта с дозировкой 9 мкг/сут, 13% – в группе фоллитропина дельта с дозировкой 12 мкг/сут и 20% – в группе приема фоллитропина бета (см. табл. 18). В 82% случаев СГЯ наблюдалось у пациенток с высоким уровнем АМГ.

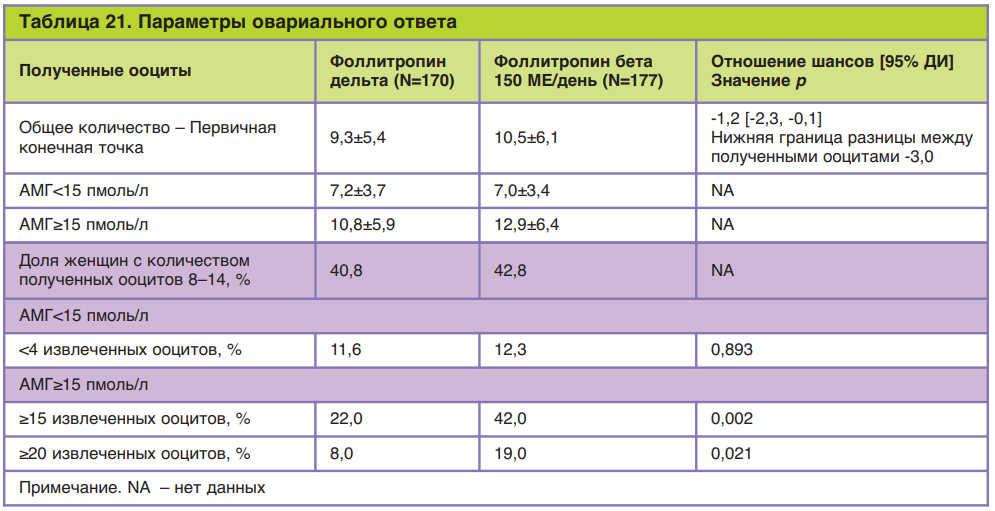
Таким образом, по итогам проведения фазы II авторы делают вывод, что ответ яичников на стимуляцию строго зависел от дозы фоллитропина дельта и исходного уровня АМГ в сыворотке. Также было установлено, что эффективность фоллитропина дельта сопоставима по сравнению с фоллитропином бета по количеству полученных ооцитов, но, тем не менее, для более детального сравнения таких показателей, как частота наступления беременности и частота развития СГЯ, необходим больший размер выборки.
Та же группа исследователей опубликовала данные фазы III рандомизированного контролируемого исследования по сравнению индивидуального расчета дозировки фоллитропина дельта по сравнению с фоллитропином бета в циклах ЭКО/ИКСИ у японских пациенток, в которое были включены 347 пациенток в возрасте от 20 до 40 лет с аналогичными критериями включения/невключения.
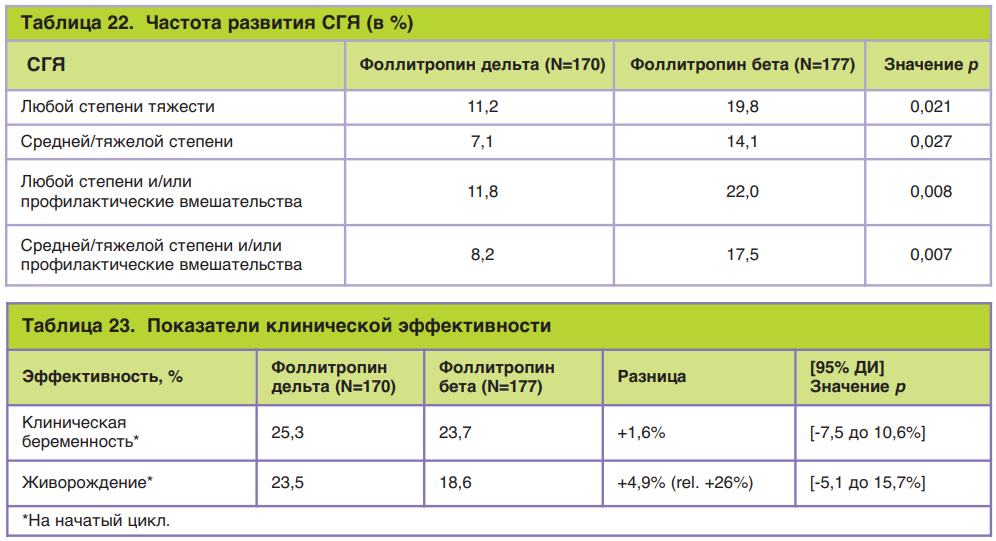
Пациентки были разделены на две группы. В первую вошли 170 пациенток, у которых выбор дозы фоллитропина дельта основывался на концентрации АМГ и массе тела: при концентрации ниже 2,1 нг/мл назначалась дозировка 12 мкг/сут, у пациенток с концентрацией АМГ 2,1 нг/мл и выше дозировка зависела от массы тела и АМГ (см. диаграмму назначения выше). Дозировка не изменялась в течение овариальной стимуляции. Во вторую группу вошли 177 пациенток, которым была назначена стартовая доза 150 мЕд фоллитропина бета в течение первых пяти дней стимуляции, после чего была возможна корректировка дозы в соответствии с ответом яичников. Шаг изменения дозы составил 75 мЕд с максимальной дозировкой 375 мЕд/сут. В этой группе пациенток в 46,3% случаев доза фоллитропина бета была изменена. В обеих группах применялся фиксированный протокол с антагонистами с началом назначения ганиреликса на 6-й день стимуляции. Общая средняя доза препарата в группе фоллитропина дельта составила 83,5 мкг и в группе фоллитропина бета – 149,9 мкг при р<0,001 (табл. 20). Продолжительность стимуляции и число полученных ооцитов в количестве менее 4 было сопоставимо в обеих группах. Однако среди пациенток с высоким овариальным резервом (АМГ>2,1 нг/мл) частота чрезмерного ответа (>15 или >20 полученных ооцитов) в груп- пе фоллитропина дельта была ниже в среднем на 50% по сравнению с группой, получавшей фоллитропин бета. При этом число полученных ооцитов в количестве 15 и более в группе фоллитропина дельта составило 22% от всех пациенток, а в группе фоллитропина бета – 42%, различия статистически достоверные, р=0,002. Число полученных ооцитов в количестве 20 и более в группе фоллитропина дельта наблюдалось в 8% случаев, в группе фоллитропина дельта – 19%, различия статистически достоверные, р=0,02. Было установлено, что эффективность фоллитропина дельта и фоллитропина бета сопоставима по количеству полученных ооцитов, среднее число полученных ооцитов в группе фоллитропина дельта составило 9,3 и в группе фоллитропина бета – 10,5 (табл. 21). Однако общая частота и частота СГЯ средней/тяжелой степени в группе фоллитропина дельта составила 11,2 и 7,1%, а в группе фоллитропина бета – 19,8 и 14,1% соответственно (СГЯ любой степени тяжести р=0,021 и СГЯ средней/тяжелой степени р=0,027; табл. 22). В обеих группах проводилось культивирование в течение 5 дней после оплодотворения и осуществлялся перенос в полость матки одной бластоцисты лучшего качества. Частота клинической беременности и родов в группе приема фоллитропина дельта составила 25,3 и 23,5%, в группе фоллитропина бета – 23,7 и 18,6% соответственно (табл. 23).
Авторы делают вывод, что фоллитропин дельта продемонстрировал сопоставимую эффективность в отношении количества полученных ооцитов по сравнению с фоллитропином бета. При этом индивидуальный подбор дозировки фоллитропина дельта позволяет уменьшить общую дозу препарата на цикл стимуляции, а также значительно снизить риск развития СГЯ в целом и СГЯ средней/тяжелой степени тяжести. Кроме того, фоллитропин дельта продемонстрировал сопоставимую эффективность по сравнению с фоллитропином бета в отношении частоты клинической беременности на начатый цикл и тенденцию к более высокой частоте живорождения.
GRAPE
Недавно завершившееся рандомизированное слепое контролируемое мультицентровое исследование GRAPE (2017–2021 гг.) выполнено для сравнения эффективности индивидуального расчета дозировки фоллитропина дельта и стандартного приема фоллитропин альфа у паназиазиатских пациенток в программах лечения бесплодия методами ВРТ из Китая, Южной Кореи, Тайваня и Вьетнама.
В исследовании GRAPE приняли участие 1009 пациенток в возрасте от 20 до 40 лет, у которых причина бесплодия заключалась в трубном, мужском факторе, эндометриозе I/II стадий; также в группу пациенток вошли женщины с бесплодием неясного генеза. Основными критериями включения были возраст от 20 до 40 лет, индекс массы тела от 17,5 до 32 кг/м2, базовая концентрация ФСГ в сыворотки крови от 1 до 15 МЕ/л, наличие регулярного менструального цикла (24–35 дней) и отсутствие предыдущих попыток лечения бесплодия методами ЭКО/ИКСИ. Основными критериями исключения служили наличие эндометриоза III/IV стадии, наличие привычного невынашивания беременности и наличие одного или более фолликулов диаметром более 10 мм на момент рандомизации.
Пациентки были разделены поровну в три возрастные группы: менее 35 лет, в возрасте 35–37 лет и 38–40 лет: 499 пациенток в группе приема фоллитропина дельта и 510 пациенток в контрольной группе приема фоллитропина альфа. Расчет дозировки фоллитропина дельта проводился на основании сывороточной концентрации АМГ и массы тела на момент рандомизации: при концентрации АМГ менее 15 пмоль/л дозировка фоллитропина дельта составляла 12 мкг независимо от массы тела; при концентрации АМГ в сыворотке крови менее 15 пмоль/л дозировка составляла 0,10–0,19 мкг/кг при минимальной суточной дозировке 6 мкг и максимальной суточной дозировке 12 мкг. Стартовая дозировка в группе фоллитропина альфа составила 150 МЕ/день, по истечении пяти дней стимуляции дозировка могла корректироваться в зависимости от индивидуального ответа яичников до максимально возможной суточной дозировки 450 МЕ/день. Все пациентки получали стандартный протокол с назначением антагонистов с шестого дня стимуляции в дозировке 0,25 мг/день до окончания стимуляции. Триггер назначали при наличии более трех фолликулов с диаметром от 17 мм. В качестве триггера выступали препараты ХГЧ при количестве фолликулов до 25 или агонисты рецептора ГнРГ при большем количестве. В случае плохого ответа яичников с визуализацией 1–2 фолликулов с диаметром от 17 мм при ультразвуковом исследовании или наличии более 35 фолликулов с диаметром более 12 мм пациента исключали из исследования.
Пункцию ооцитов назначали спустя 36±2 ч после введения триггера, оплодотворение проводили методами ЭКО/ИКСИ спермой партнера. На третий день культивирования осуществляли перенос эмбриона наилучшего качества, остальные криоконсервировали на стадии бластоцист.
Средняя продолжительность стимуляции в группах приема фоллитропинов альфа и дельта составила 8,7±5,5 и 7,0±4,8 дня, соответственно, с общей дозой препаратов 109,9±2,9 мкг (фоллитропин альфа) и 77,5±24,4 мкг (фоллитропин дельта) (табл. 24). Желаемый эффект по количеству полученных ооцитов (от 8 до 14 ооцитов) достигнут в 42,6 и 46,7% случаев при стимуляции фоллитропинами альфа и дельта соответственно. У женщин с риском развития СГЯ (с концентрациями АМГ более 15 пмоль/л) после стимуляции фоллитропином альфа на пункции получали более 15 и 20 фолликулов в 39,1 и 18,5% соответственно; при стимуляции фоллитропином дельта – 20,2 и 6,7%
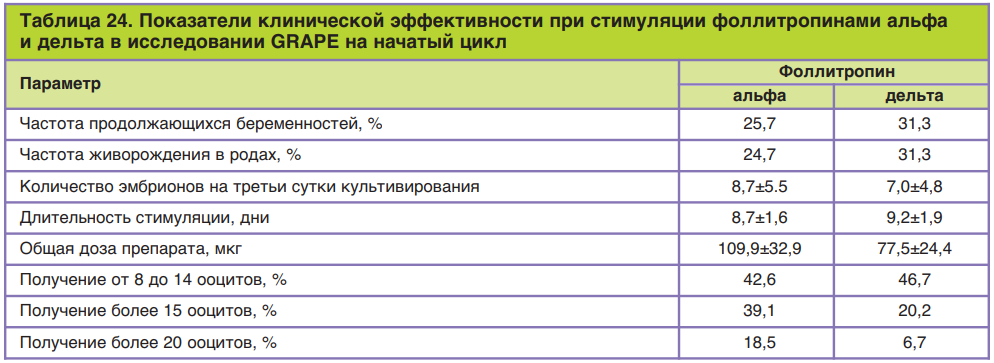
соответственно. Результаты по частоте развивающейся беременности в группе фоллитропина дельта сопоставимы с группой фоллитропина альфа (31,3% vs 25,7%). По частоте живорождения индивидуальный режим дозирования фоллитропина дельта показал преимущество (31,3% vs 24,7%). Полученные данные коррелируют с результатами предыдущих исследований ESTER-1 и STORK, которые показывают эффективность индивидуального расчета дозировки фоллитропина у пациентов с риском СГЯ. В ходе исследований ранняя степень СГЯ без обращения за медицинской помощью выявлена у 4,0% в группе приема фоллитропина дельта и 6,5% – в группе приема фоллитропина альфа; с превентивными мерами – 5,0 и 9,6% соответственно.
Клинические случаи
Модель зависимости расчета дозировки препарата Рековелль® от биомаркеров построена на основании полученных результатов второй фазы исследования, где оценивались данные пациентов с концентрацией АМГ в сыворотке от 5,0 до 44,9 пмоль/л. В третьей фазе исследования у 9,4% пациентов концентрация АМГ составляла менее 4,9 пмоль/л у 4,8 % – более 44,9 пмоль/л. В связи с этим, в группе пациентов с концентрацией АМГ менее 5,0 пмоль/л при назначении 12 мкг/сут препарата Рековелль® ожидается получение менее 8 ооцитов, т.е. меньше целевого уровня. Выбор дозировки в данном случае основан не на увеличении вероятности наступления беременности, а на получении адекватного количества ооцитов, по крайней мере не меньшего количества ооцитов при более высокой дозе р-чФСГ. В группе пациентов с концентрацией АМГ более 40 пмоль/л расчет дозировки препарата Рековелль® в расчете 0,1 мкг на 1 кг массы тела приводит к получению примерно 11 ооцитов и резко снижает развитие СГЯ.
Максимальная суточная доза для первого цикла лечения составляет 12 мкг. Для женщин с концентрацией АМГ<15 пмоль/л суточная доза составляет 12 мкг вне зависимости от массы тела. Для пациенток с концентрацией АМГ≥15 пмоль/л суточная доза снижается с 0,19 до 0,10 мкг/кг при повышении концентрации АМГ (см. таблицу расчета суточной дозы по массе тела и концентрации АМГ). Дозу следует округлить до 0,33 мкг, для соответствия шкале дозирования на ручке для инъекций.
Стоит отметить, что концентрация АМГ должна быть выражена в пмоль/л и округляться до ближайшего целого числа. Если результат АМГ выражен в нг/мл, его следует преобразовать в пмоль/л умножением значения на 7,14 (нг/мл × 7,14 = пмоль/л) перед использованием предложенного алгоритма.
Для последующих циклов лечения следует придерживаться выбранной ежедневной дозировки препарата фоллитропина дельта или корректировать ее в зависимости от предыдущего ответа яичников на стимуляцию. Если у пациентки адекватная реакция яичников на стимуляцию, получено целевое количество ооцитов, нет СГЯ, то следует использовать ту же дозировку препарата в последующих циклах. В случае недостаточного ответа, рекомендовано увеличить дозу препарата на 25%. Максимальная дневная доза препарата составляет 24 мкг.
Случай 1. Ожидаемый нормоответ с нормальными показателями овариального резерва, отсутствием сочетанной патологии и хорошим прогнозом
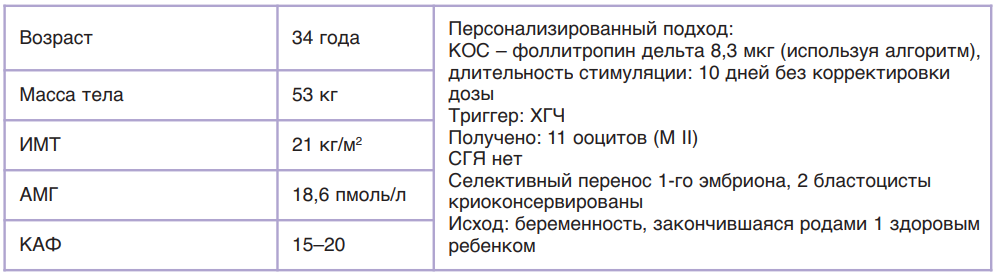
В данном клиническом примере ежедневная доза фоллитропина дельта составляет 8,3 мкг, что позволило получить 11 зрелых ооцитов без риска развития СГЯ.
Случай 2. Ожидаемый гипооответ со сниженным овариальным резервом, в позднем репродуктивном возрасте и неудачным протоколом КОС в анамнезе
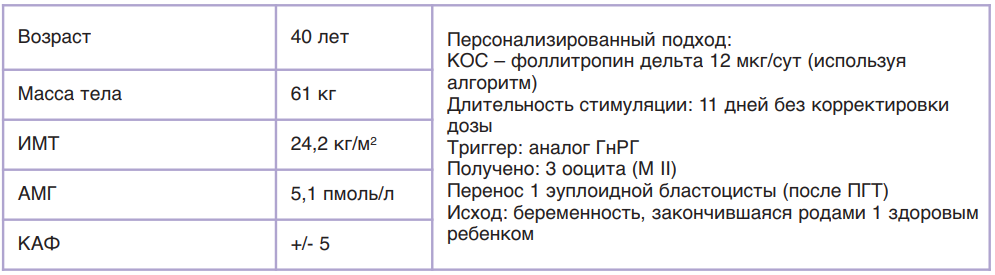
У данного пациента в анамнезе неудачный протокол КОС, который был проведен с применением рФСГ в ежедневной дозировке 450 МЕ, и исходом протокола были 3 зрелых ооцита, трансфер 1-й бластоцисты, закончившийся беременностью и прерыванием на раннем сроке (6 недель).
Случай 3. Ожидаемый гиперответ с СПКЯ и уровнем АМГ 74 пмоль/л
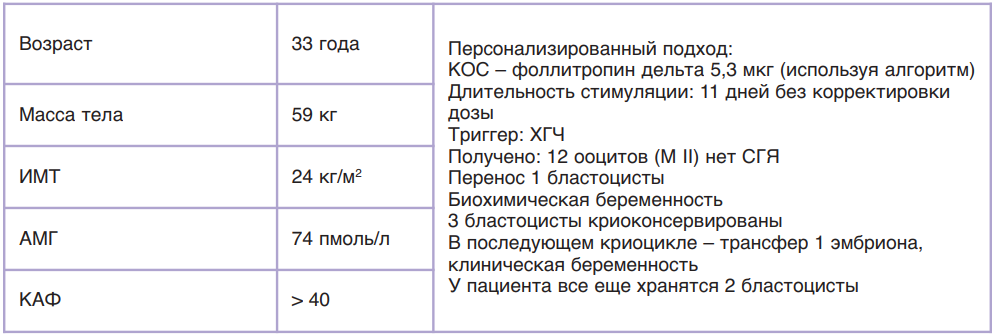
Фармакокинетические данные
Фармакокинетический профиль фоллитропина дельта был исследован у здоровых женщин и у пациентов с ЭКО/ИКСИ, перенесших КОС. После ежедневных подкожных введений препарата Рековелль® концентрация фоллитропина дельта достигает равновесного состояния в течение 6–7 дней с концентрацией в 3 раза большей по сравнению с концентрацией после первого введения. Концентрации циркулирующего в кровеносном русле фоллитропина дельта обратно пропорциональны массе тела, что поддерживает принцип индивидуального расчета дозировки в зависимости от массы тела.
Абсорбция
После ежедневного подкожного введения препарата Рековелль® время достижения максимальной концентрации в сыворотке крови составляет 10 ч. Абсолютная биодоступность составляет около 64%.
Распределение
Кажущийся объем распределения составляет около 25 л после подкожного введения и 9 л – после внутривенного введения. В пределах терапевтического диапазона доз воздействие фоллитропина дельта увеличивается пропорционально дозировке.
Элиминация
После подкожного введения очевидный клиренс фоллитропина дельта составляет 0,6 л/ч, а клиренс после внутривенного введения составляет 0,3 л/ч. Конечный период полувыведения после однократного подкожного введения составляет 40 ч, а после многократного подкожного введения – 28 ч. Очевидный клиренс фоллитропина дельта низкий, то есть 0,6 л/ч после многократного подкожного введения, что приводит к высокому воздействию. Фоллитропин дельта выводится так же, как и другие фоллитропины, то есть в основном почками. Доля фоллитропина дельта, выводимая с мочой в неизмененном виде, составляет около 9%.
Фармацевтические данные
В состав готовой лекарственной формы, помимо фармакологически активной субстанции, входят: фенол, полисорбат-20, L-метионин, натрия сульфат декагидрат, динатрия фосфат додекагидрат, ортофосфорная кислота (концентрированная) и натрия гидроксид для коррекции рН, а также вода для инъекций. Большинство из вспомогательных веществ имеют статус GRAS (Generally Regarded as Safe) и разрешены в Европе для использования в качестве пищевой добавки, включены в базу данных вспомогательных веществ Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA от англ. US Food and Drug Administration). Таким образом, вспомогательные ингредиенты, входящие в состав препарата в данных концентрациях, характеризуются благоприятным профилем безопасности, разрешены и широко применяются в составе фармацевтических препаратов и пищевой промышленности, придавая препарату высокие потребительские характеристики.
Препарат Рековелль® имеет длительный срок годности (3 года) и практичен в использовании: препарат может храниться до трех месяцев при температуре 25 °С без повторного охлаждения (включая период после первого использования). Однако после первого применения картридж в составе шприц-ручки следует хранить не более 28 суток при температуре 25 °C или ниже [36].
Список литературы
- Cushing H.S.J.C.J.H. Experimental hypophysectomy // Bull Johns Hopkins Hosp. – 1910. – Vol. 21. – P. 127–167.
- Aschner B. Ueber die Beziehungen zwischen Hypophysis und Genitale // Archiv fur Gynakologie. Springer-Verlag. 1912. – Vol. 97 (2). – P. 200–228.
- Lunenfeld B. Historical perspectives in gonadotrophin therapy // Human Reproduction Update. Oxford Academic. 2004. – Vol. 10 (6). – P. 453–467.
- Practice Committee of the American Society for Reproductive Medicine T. Gonadotropin preparations: past, present, and future perspectives // Fertility and Sterility. – 2008. – Vol. 90 (5). – P. 13– 20.
- Gotschall R.R., Bousfield G.R. Oligosaccharide Mapping Reveals Hormone-Specific Glycosylation Patterns on Equine Gonadotropin alpha-Subunit Asn56 // Endocrinology. – 1996. – Vol. 137 (6). – P. 2543–2557.
- Bousfield G.R. et al. In Vivo and In Vitro Impact of Carbohydrate Variation on Human Follicle-Stimulating Hormone Function // Frontiers in endocrinology. Frontiers Media S.A. – 2018. – Vol. 9 (5). – P. 216.
- Smitz J. et al. Follicle-Stimulating Hormone: A Review of Form and Function in the Treatment of Infertility // Reproductive Sciences. – 2016. – Vol. 23 (6). – P. 706–716.
- de Pascali F. et al. Follicle-Stimulating Hormone Receptor: Advances and Remaining Challenges // International Review of Cell and Molecular Biology. 2018. – Vol. 338. – P. 1–58.
- Bousfield G.R., Harvey D.J. Follicle-stimulating hormone glycobiology // Endocrinology. – 2019. – Vol. 160 (6). – P. 1515–1535.
- Rajendra Kumar J.S.D. Naturally Occurring Follicle-Stimulating Hormone Glycosylation Variants // Journal of Glycomics & Lipidomics. 2014. – Vol. 4 (2).
- Jiang C. et al. Hypoglycosylated hFSH has greater bioactivity than fully glycosylated recombinant hFSH in human granulosa cells // Journal of Clinical Endocrinology and Metabolism. – 2015. – Vol. 100 (6). – P. E852–E860.
- Dias J.A., Ulloa-Aguirre A. New Human Follitropin Preparations: How Glycan Structural Differences May Affect Biochemical and Biological Function and Clinical Effect // Frontiers in Endocrinology. 2021. – Vol. 12. – P. 636038.
- Ulloa-Aguirre A. et al. Structure-Function Relationships of the Follicle-Stimulating Hormone Receptor // Frontiers in Endocrinology. – 2018. – Vol. 9. – P. 707.
- Шпаков А.О. Гонадотропины – от теории к клинической практике. Санкт-Петербург: Политех-Пресс, 2018.
- Flack M.R. et al. Site-directed mutagenesis defines the individual roles of the glycosylation sites on follicle-stimulating hormone // Journal of Biological Chemistry. 1994. – Vol. 269 (19) – P. 14015– 14020.
- Bousfield G.R. et al. Hypo-glycosylated human follicle-stimulating hormone (hFSH21/18) is much more active in vitro than fully-glycosylated hFSH (hFSH24) // Molecular and Cellular Endocrinol- ogy. 2014. – Vol. 382 (2). – P. 989–997.
- Butnev V.Y. et al. Production, purification, and characterization of recombinant hFSH glycoforms for functional studies // Molecular and Cellular Endocrinology.– 2015. – Vol. 405. – P. 42–51.
- Bhaskaran R.S., Ascoli M. The post-endocytotic fate of the gonadotropin receptors is an important determinant of the desensitization of gonadotropin responses // Journal of Molecular Endocrinol- ogy. – 2005. – Vol. 34 (2). – P. 447–457.
- Calebiro D. et al. Persistent cAMP-Signals Triggered by Internalized G-Protein–Coupled Receptors / ed. von M. Zastrow // PLoS Biology. – 2009. – Vol. 7 (8). – P. e1000172.
- Kluetzman K.S. et al. Decreased degradation of internalized follicle-stimulating hormone caused by mutation of aspartic acid 6.30550 in a protein kinase-CK2 consensus sequence in the third in- tracellular loop of human follicle-stimulating hormone receptor // Biology of Reproduction. Biol Reprod. – 2011. – Vol. 84 (6). – P. 1154–1163.
- Ulloa-Aguirre A., , Zariñán T. The follitropin receptor: Matching structure and function // Molecular Pharmacology. American Society for Pharmacology and Experimental Therapy, 2016. – Vol. 90 (5). – P. 596–608.
- Correction: The follitropin receptor: Matching structure and function (Molecular Pharmacology (2016) 90:5 (596-608) DOI: 10.1124/mol.116.104398) // Molecular Pharmacology. American Society for Pharmacology and Experimental Therapy. 2017. – Vol. 91 (1). – P. 48.
- Song Y. et al. Follicle-stimulating hormone induces postmenopausal dyslipidemia through inhibiting hepatic cholesterol metabolism // Journal of Clinical Endocrinology and Metabolism. 2016. – Vol. 101 (1). – P. 254–263.
- Гонадотропины: история создания. Чеботникова. Вестник репродуктивного здоровья [Electronic resource]. URL: источник (ac- cessed: 23.04.2021).
- Leão R. de B.F., Esteves S.C. Gonadotropin therapy in assisted reproduction: An evolutionary perspective from biologics to biotech // Clinics. – 2014. – Vol. 69 (4). – P. 279–293.
- GONAL-f. European Medicines Agency [Electronic resource]. URL: источник (accessed: 21.04.2021).
- Goa K.L., Wagstaff A.J. Follitropin alpha in infertility: A review // BioDrugs. – 1998. – Vol. 9 (3). – P. 235–260.
- de Leeuw R. et al. Structure-function relationship of recombinant follicle stimulating hormone (Puregon®) // Molecular Human Reproduction. – 1996. – Vol. 2 (5). – P. 361–369.
- Bassett R.M., Driebergen R. Continued improvements in the quality and consistency of follitropin alfa, recombinant human FSH // Reproductive BioMedicine Online. 2005. – Vol. 10 (2). – P. 169– 177.
- Lunenfeld B. et al. The development of gonadotropins for clinical use in the treatment of infertility // Frontiers in Endocrinology. 2019. – Vol. 10 (6).
- Medicines Agency E. Biosimilars in the EU – Information guide for healthcare professionals. URL: источник
- Orvieto R., Seifer D.B. Biosimilar FSH preparations- are they identical twins or just siblings? // Reproductive Biology and Endocrinology. – 2016. – Vol. 14 (1).
- Koechling W. et al. Comparative pharmacology of a new recombinant FSH expressed by a human cell line // Endocrine Connections. 2017. – Vol. 6 (5). – P. 297–305.
- Olsson H., Sandström R., Grundemar L. Different pharmacokinetic and pharmacodynamic properties of recombinant follicle-stimulating hormone (rFSH) derived from a human cell line compared with rFSH from a non-human cell line // Journal of Clinical Pharmacology. – 2014. – Vol. 54 (11). – P. 1299–1307.
- Abd-Elaziz K. et al. A new fully human recombinant FSH (follitropin epsilon): Two phase i randomized placebo and comparator-controlled pharmacokinetic and pharmacodynamic trials // Human Reproduction. 2017. – Vol. 32 (8). – P. 1639–1647.
- Rekovelle. European Medicines Agency [Electronic resource]. URL: источник (accessed: 21.04.2021).
- US9527899B2 – Recombinant human follicle-stimulating hormone – Google Patents [Electronic resource]. URL: источник (accessed: 21.04.2021).
- Pouwer A.W., Farquhar C., Kremer J.A.M. Long-acting FSH versus daily FSH for women undergoing assisted reproduction // Cochrane Database of Systematic Reviews. – 2012. – Vol. 2012 (6).
- Elonva / European Medicines Agency [Electronic resource]. URL: источник (accessed: 21.04.2021).
- Fensore S., di Marzio M., Tiboni G.M. Corifollitropin alfa compared to daily FSH in controlled ovarian stimulation for in vitro fertilization: A meta-analysis // Journal of Ovarian Research. 2015. – Vol. 8 (1). – P. 33.
- Klein J. et al. Development and characterization of a long-acting recombinant hFSH agonist // Human Reproduction. – 2003. – Vol. 18 (1). – P. 50–56.
- Goods Administration T. Australian Public Assessment Report for Follitropin delta (rhu) About the Therapeutic Goods Administration (TGA). 2017.
- Li H.W.R., Nelson S.M. Clinical Application of AMH Measurement in Assisted Reproduction // Frontiers in Endocrinology. – 2020. – Vol. 11.
- Nelson S.M. et al. Anti-Müllerian hormone variability and its implications for the number of oocytes retrieved following individualized dosing with follitropin delta // Clinical Endocrinology. – 2019.– Vol. 90 (5). – P. 719–726.
- Nelson S.M. et al. Two new automated, compared with two enzyme-linked immunosorbent, anti-müllerian hormone assays // Fertility and Sterility. – 2015. – Vol. 104 (4). – P. 1016–1021.e6.
- Moolhuijsen L.M.E., Visser J.A. Anti-Müllerian Hormone and Ovarian Reserve: Update on Assessing Ovarian Function // Journal of Clinical Endocrinology and Metabolism. – 2020. – Vol. 105 (11). – P. 3361–3373.
- Tal R., Seifer D.B. Ovarian reserve testing: a user’s guide // American Journal of Obstetrics and Gynecology. – 2017. – Vol. 217 (2). – P. 129–140.